
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 饱和硫酸铵和醋酸铅溶液均能使鸡蛋清溶液发生变性 | |
| C. | 油脂、二肽发生水解反应均可能得到含羧基的物质 | |
| D. | 天然橡胶 和杜仲胶 和杜仲胶 的单体是同种物质 的单体是同种物质 |
分析 A、麦芽糖及其水解产物葡萄糖有醛基;
B、硫酸铵能使蛋白质发生盐析;
C、油脂水解得到高级脂肪酸和甘油;二肽水解得到氨基酸;
D、天然橡胶 和杜仲胶
和杜仲胶 互为顺反异构.
互为顺反异构.
解答 解:A、麦芽糖及其水解产物葡萄糖有醛基,能发生银镜反应,故A正确;
B、硫酸铵能使蛋白质发生盐析,重金属盐醋酸铅能使蛋白质变性,故B错误;
C、油脂水解得到高级脂肪酸和甘油;二肽水解得到氨基酸,故水解产物中均含羧基,故C正确;
D、天然橡胶 和杜仲胶
和杜仲胶 互为顺反异构,两者的单体均为2-甲基-1,3-丁二烯,故D正确.
互为顺反异构,两者的单体均为2-甲基-1,3-丁二烯,故D正确.
故选B.
点评 本题考查了还原性糖、蛋白质的盐析和变性的区别、油脂和肽的水解产物,难度不大,应注意的是可溶性重金属盐能使蛋白质变性.


科目:高中化学 来源: 题型:选择题
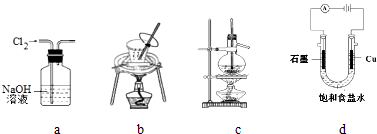
| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置从饱和食盐水中提取氯化钠 | |
| C. | 用图c所示装置制取乙烯气体 | |
| D. | 用图d所示装置制取Cl2、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 由图象可推知,反应温度T2>T1 | |
| B. | 同一温度,增大压强,平衡右移,平衡常数K增大 | |
| C. | 同一温度,当a=0.5时,CO转化率最高 | |
| D. | 对于状态I和II,若再向体系中充入He,重新达到平衡后,二者的平衡体系中CH3OH的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

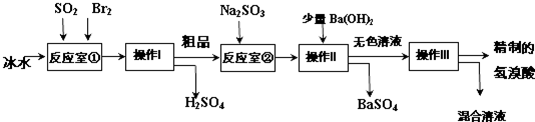
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 电解质溶液 | 实验现象 | |
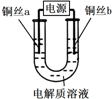 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O; ③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu; ④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量使用化肥和农药,能不断提高农作物产量 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于净水 | |
| B. | 氨可用于生产铵盐、纯碱 | |
| C. | 铝热反应可用于冶炼某些金属 | |
| D. | 核磁共振氢谱可用于测量某些有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
mgO2中含n个氧原子,则阿伏加德罗常数的值可表示为
A.2n B.16n/m C.32n/m D.n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com