
【题目】R为1~18号元素,其原子所具有的电子层数为最外层电子数的![]() ,它可能形成的
,它可能形成的
含氧酸根离子有:①RO32-,②RO42-,③R2O32-,下列叙述判断正确的是
A. 当它可以形成①时,不可能形成③ B. 当它形成①时,也可以形成②和③
C. 当它可以形成②时,不可能形成③ D. 当它可以形成①时,不可能形成②
【答案】B
【解析】试题分析:R为1~18号元素,其原子所具有的电子层数为最外层电子数的![]() ,若R的电子层为1,则核外电子数为2,为He元素,He性质稳定,没有含氧酸根;若R的电子层为2,则最外层电子数为4,为C元素;若R的电子层为3,则最外层电子数为6,为S元素.A、当R可以形成RO32-时,是CO32-或SO32-,故R为C元素或S元素,S元素可以形成S2O32-,故A错误;B、当R可以形成RO32-时,R为+4价, R为C元素或S元素,S元素可以形成S2O32-、SO42-,故B正确;C、当R可以形成RO42-时,是SO42-,故R为S元素,S元素不可能形成、S2O32-形式的离子,故C错误;D、当R可以形成②RO42-时,R为+6价,故R为S元素,S元素可以形成SO42-形式的离子,故D错误。
,若R的电子层为1,则核外电子数为2,为He元素,He性质稳定,没有含氧酸根;若R的电子层为2,则最外层电子数为4,为C元素;若R的电子层为3,则最外层电子数为6,为S元素.A、当R可以形成RO32-时,是CO32-或SO32-,故R为C元素或S元素,S元素可以形成S2O32-,故A错误;B、当R可以形成RO32-时,R为+4价, R为C元素或S元素,S元素可以形成S2O32-、SO42-,故B正确;C、当R可以形成RO42-时,是SO42-,故R为S元素,S元素不可能形成、S2O32-形式的离子,故C错误;D、当R可以形成②RO42-时,R为+6价,故R为S元素,S元素可以形成SO42-形式的离子,故D错误。


科目:高中化学 来源: 题型:
【题目】生活处处有化学。下列说法正确的是 ( )
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是

A. 电极a为电池的正极
B. 电极b上发生的电极反应为:O2+2H2O+4e![]() =" 4" OH
=" 4" OH![]()
C. 电路中每流过4mol电子,电池内部释放632kJ热能
D. 每17gH2S参与反应,有1mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展“绿色食品”是提高人类生存质量的重要措施,绿色食品指( )
A.绿颜色的营养食品 B.含叶绿素的营养食品
C.植物类营养食品 D.安全无公害的营养食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HC1O4可以类推出氟元素也存在最高价氧化物的水化物HFO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
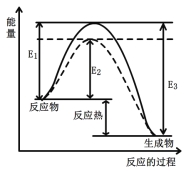

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:

已知:ⅰ.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。
(1)为了提高硼镁矿粉的浸出率,可采取的措施有 (至少答两条)
(2)“浸出液”显酸性,含H3BO3和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, H2O2的作用是 (用离子方程式表示),MgO除去的杂质离子是 。
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式 。
(4)“浸取”后,采用“热过滤”的目的是 ,母液中的主要溶质有 。
(5)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的 措施是将“母液”蒸发浓缩,____________
(6)测定所得产品的纯度:取ag 硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体bg,则产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J具有抗缺血性脑损伤的作用,合成J的一种路线如下:

已知:①
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
回答下列问题:
(1)D所含有官能团的名称 。
(2)由D生成E的化学方程式为 ,其反应类型为
(3)G的结构简式为 。
(4)C的某同系物X,相对分子质量比C大14,X的结构有 种,其中核磁共振氢谱为4组峰,且锋面面积比为1:2:2:2的是 (写结构简式)。
(5)由甲醛和化合物A经下列步骤可得到2-苯基乙醇。
![]()
反应条件1为 ;反应条件2所选择的试剂为 ;L的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1 一丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH![]() CO+H2O,并设计出原料气的制备装置(如图)。
CO+H2O,并设计出原料气的制备装置(如图)。

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式:_______________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)
① 饱和Na2SO3溶液② 酸性KMnO4溶液③ 石灰水④ 无水CuSO4 ⑤ 品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_____________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:① RCHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为_________,操作1为__________,操作2为__________,操作3为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com