
室温下,对于CH3COONa的说法下列判断正确的是
A.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.升高温度,c(OH—)与c(CH3COO—)的比值将减小
C.CH3COONa稀溶液加水稀释时,溶液中各离子浓度均减小
D.c(CH3COO-)+ c(CH3COOH)=c(Na+)
科目:高中化学 来源:2014-2015广东省湛江市高二第一学期期末化学试卷(解析版) 题型:实验题
(10分)已知草酸晶体( )可溶于水,并可与酸性高锰酸钾溶液完全反应:
)可溶于水,并可与酸性高锰酸钾溶液完全反应:

现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000 mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在 (填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是 (填序号)。
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是 。
(4)根据上述数据计算X= 。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 ;
②若KMnO4标准溶液浓度偏低,则X值 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列生活常见现象中,没有涉及化学变化的是
A.植物的光合作用 B.从海水中提取氯化钠
C.铁钉生锈 D.石灰岩风化
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.硫酸、纯碱、碳酸钠和生石灰分别属于酸、碱、盐和氧化物
B.光导纤维是以硅为主要原料制成的
C.可依据是否有丁达尔现象区分溶液与胶体
D.Fe(OH)3难溶于水,不存在氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高二上学期期末化学试卷(解析版) 题型:简答题
(12分)请仔细观察下列三种装置的构造示意图。根据要求回答问题:

(1)电解精炼铜(如图1)时,b极材料是________(填“纯铜”或“粗铜”);其电解质溶液能否用CuCl2替代?答:________(“能”或“否”)。
(2)碱性锌锰电池(如图2)的总反应式为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,该电池的负极反应式为______________________。若有0.65g锌参与了电池反应,则转移电子的物质的量为 mol。
(3)铅-硫酸蓄电池(如图3)放电过程中,负极的电极反应式为 ,充电时,Pb电极应接电源的______极(填“正极”或“负极”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
用石墨电极,电解一定浓度的下列四种物质的水溶液。电解一段时间后,若只往所得溶液中适量的水,可以恢复到电解前的状态。该物质是
A.AgNO3 B.NaCl C.KOH D.CuCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:实验题
某实验小组同学为了探究SO2的性质,进行了如下实验(实验前,装置内空气已排尽):

已知:硫酸的沸点是338℃,酒精灯可加热至400℃以上。
主要实验步骤:
①加热试管A直到B、D中均出现大量白色沉淀,熄灭酒精灯;
②将Cu丝上提离开液面;
③从导管F口向装置中通入空气一段时间。
(1)试管A中发生的主要反应的化学方程式为 。
(2)试管B中出现白色沉淀的原因是 。
(3)试管C中溶液褪色,说明SO2具有 (填“漂白性”或“氧化性”或“还原性”),请将该反应的离子方程式补充完整:
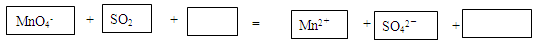
(4)试管D中发生反应的离子方程式为 。
(5)下列叙述正确的是 。
a.上下移动铜丝可控制生成SO2的量
b.为确认有CuSO4生成,可向试管A中加水,观察颜色
c.步骤③可使装置中残留气体完全被吸收,避免污染空气
d.熄灭酒精灯后, B中的液体不会倒吸,因为空气可经导管F进入试管A,使压强平衡
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
用下图装置(夹持、加热装置已略)进行实验,由②中现象不能证实①中反应发生的是

①中实验 | ②中现象 | |
A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | 加热CaCO3固体 | 澄清石灰水变浑浊 |
D | 加热KClO3和MnO2的混合物 | 用带火星的木条伸入试管②,木条复燃 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度先减小再增大
B.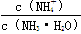 始终增大
始终增大
C.n (CH3COOH)与n (CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,溶液的PH一定为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com