
【题目】下列叙述正确的是
A. 离子化合物中可能含有共价键 B. 化学键是分子间强烈的作用力
C. H、D、 T表示三种氢元素 D. 共价化合物中各原子都一定满足最外层8电子稳定结构
科目:高中化学 来源: 题型:
【题目】下列变化中,吸收的热量用于克服分子间作用力的是( )
A. 液氨受热蒸发 B. 加热金属铝使之熔化
C. 加热食盐晶体使之熔化 D. 加热硅晶体使之熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向猪膀胱内注入一半质量分数为30%的蔗糖溶液,扎紧入口,然后将其浸入质量分数为5%的蔗糖溶液中,每隔10 min称一次猪膀胱的重量,能正确表示测定结果的是下图中的
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子电子层数相同的X、Y、Z三种元素,若最高价氧化物的水化物酸性强弱为H3XO4<H2YO4<HZO4,则下列判断正确的是
A.非金属性强弱为X>Y>Z
B.原子半径为X<Y<Z
C.阴离子的还原性为X3->Y2->Z-
D.气态氢化物的稳定性为H3X>H2Y>HZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置________________。
(2)写出B单质的电子式________________。
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_________________________。
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:__________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________。
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_________________________________________________________。
(7)写出由A和D形成的化合物与水反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(NH2CONH2)是目前含氮量最高的氮肥。国内外主要以NH3和CO2为原料进行合成。主要通过以下二个反应进行:
第一步:2NH3(l)+CO2(g)![]() H2NCOONH4(l) △H1=-117.2kJ·mol-1
H2NCOONH4(l) △H1=-117.2kJ·mol-1
第二步:H2NCOONH4(l)![]() H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
请回答:
(1)己知:NH3(l)![]() NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)
NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)![]() 2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
(2)①一定条件下,n(NH3)/n(CO2)对NH2COONH4的平衡转化率会产生明显的影响,如图1所示。NH2COONH4的平衡转化率随n(NH3)/n(CO2)增大而上升,试分析其原因:_______________。

②恒温密闭容器中,一定量的NH3和CO2反应合成尿素,第10 min达到平衡。若相同条件下反应1的速率要快于反应2,请在图中画出0~15min内,NH2COONH4的物质的量浓度随时间变化曲线____________。

③下图表示不同条件下,反应:N2(g) +3H2(g)![]() 2NH3(g)的产物浓度随时间的变化曲线。
2NH3(g)的产物浓度随时间的变化曲线。
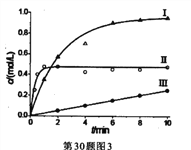
下列有关说法中,正确的是____________。
A.达到平衡时间最快的是II
B.反应约10分钟后,三个反应均己达到平衡
C.I条件下氢气的平衡转化率大于Ⅱ
D.三个反应的平衡常数一定相同
(3)用电化学方法可以实现低温常压合成氨。下图是以含N3-熔融盐为电解质,电解合成氨装置的工作原理示意图。阴极的电极反应是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂中无法鉴别对应物质的是
选项 | 物质 | 试剂 |
A | 乙醛 甲苯和CCl4 | 水 |
B | 甲烷 乙炔和四氯化碳 | 溴水 |
C | 乙醇 乙酸和乙酸乙酯 | 饱和碳酸钠溶液 |
D | 苯甲醇 苯甲醛和苯甲酸 | 酸性高锰酸钾溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 °C时,向100 mL含HCl 14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是____________________。
(2)在后4 min内用HCl表示的平均反应速率是____________________。
(3)前2 min与后4min相比,反应速率较快的是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com