
| A. | CH3OOCCH3名称为甲酸乙酯 | |
| B. | 次氯酸的电子式  | |
| C. | 17Cl原子3p亚层有一个未成对电子 | |
| D. | 碳原子最外层电子云有两种不同的伸展方向 |
分析 A.酯命名是根据生成酯的酸和醇来命名为某酸某酯;
B.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
C.17Cl原子外围电子排布为3s23p5;
D.碳原子最外层有4个电子,分别是两个2s、两个2p电子,s电子的电子云为球形,p电子的电子云有3种伸展方向.
解答 解:A.酯的命名是根据生成酯的酸和醇来命名为某酸某酯,此有机物是由甲醇和乙酸酯化得到的,故为乙酸甲酯,故A错误;
B.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为: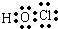 ,故B错误;
,故B错误;
C.17Cl原子3p亚层上只有一个未成对电子的原子,其外围电子排布为3s23p5,故C正确;
D.碳原子最外层有两个2s、两个2p电子,s电子的电子云为球形,p电子的电子云为纺锤形,有3种伸展方向,故D错误.
故选C.
点评 本题考查了化学用语,涉及有机物的命名、电子式和原子结构等知识点,注意离子化合物和共价化合物电子式的书写区别,难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
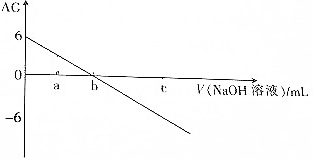
| A. | 若a点加入NaOH溶液的体积为10mL,则溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | b点加入NaOH溶液的体积为20mL | |
| C. | b点时,溶液中存在:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 若c点加入NaOH溶液的体积为40mL,则溶液中:c(CH3COO-)+2c(CH3C00H)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(H+)=1.0×10-2 mol/L | |
| B. | 此溶液中由水电离出的c(OH-)=1.0×10-12 mol/L | |
| C. | 加水稀释100倍后,溶液的pH=4 | |
| D. | 加入等体积pH=12的氨水,溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a g混合物用酒精灯充分加热后质量减少bg | |
| B. | 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bg | |
| C. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴甲基橙指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL | |
| D. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量Ca(OH)2溶液反应,转移的电子数为NA | |
| B. | 1 mol碳烯(:CH2)所含的电子数目为6 NA | |
| C. | 常温常压下,11.2 L甲烷中含有的氢原子数小于2 NA | |
| D. | 某温度时,1 L pH=6的纯水中含OH-数为10-6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为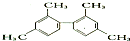 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 | |
| B. | 苯中含有杂质苯酚,可用浓溴水来除杂 | |
| C. | 1mo1 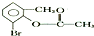 在一定条件下与足量NaOH溶液反应,最多消耗3 mol NaOH 在一定条件下与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| D. | 按系统命名法,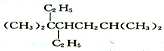 的名称为3,3,6一三甲基-4-乙基庚烷 的名称为3,3,6一三甲基-4-乙基庚烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com