
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
分析 分子间氢键的存在导致物质熔沸点升高、溶解性增大,且同分异构体中分子内氢键导致物质的熔沸点较低、分子间氢键导致物质熔沸点升高,据此分析解答.
解答 解:分子间氢键的存在导致物质熔沸点升高、溶解性增大,且同分异构体中分子内氢键导致物质的熔沸点较低、分子间氢键导致物质熔沸点升高,
①第VA族中只有N的氢化物中含有氢键,氢键的存在导致氨气熔沸点升高,所以NH3的熔、沸点比VA族其它元素氢化物的高,故正确;
②小分子的醇、羧酸都可以和水形成分子间氢键,导致溶解性增大,所以可以和水以任意比互溶,故正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,所以冰的密度比液态水的密度小,故正确;
④尿素分子间可以形成的氢键比醋酸分子间形成的氢键多,尿素的熔、沸点比醋酸的高,故正确;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故正确;
⑥NH3分子加热难分解与其化学键有关,与氢键无关,故错误;
故选B.
点评 本题考查氢键对物质性质的影响,注意氢键只影响物质物理性质不影响化学性质,氢键属于分子间作用力,不属于化学键,为易错点.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
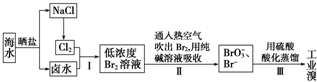
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
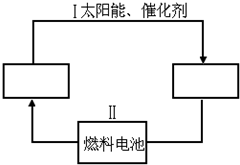 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
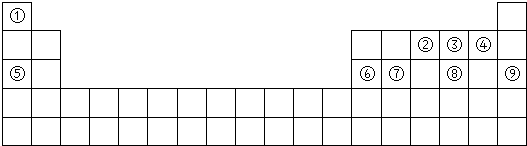
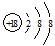
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
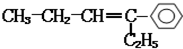 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,10 | B. | 4,3,12 | C. | 4,2,7 | D. | 4,5,10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl、CaO、HCl | B. | H2S、SiO2、HNO3 | ||
| C. | CO2、CH4、Na2O2 | D. | CH3COOH、PH3、BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com