
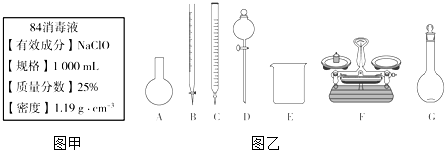
分析 (1)根据含25%NaClO、1000mL、密度1.19g•cm-3,结合c=$\frac{1000ρω}{M}$来计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)根据溶液的配制及c=$\frac{n}{V}$、m=nM来分析;
(4)根据溶液稀释前后溶质的物质的量不变计算.
解答 解:(1)c(NaClO)=c=$\frac{1000ρω}{M}$=$\frac{1000×1.1.9×25%}{74.5}$=4.0 mol•L-1,
故答案为:4.0;
(2)稀释前后溶液中NaClO的物质的量不变,则有:100 mL×10-3 L•mL-1×4.0 mol•L-1=100 mL×100×10-3 L•mL-1×c(NaClO),解得稀释后c(NaClO)=0.04 mol•L-1,c(Na+)=c(NaClO)=0.04 mol•L-1,
故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol•L-1×74.5 g•mol-1=149 g,故D错误;
故答案为:C;
(4)溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=$\frac{1000×1.84×98%}{98}$=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,
故答案为:250.
点评 本题考查物质的量浓度的计算以及溶液的配制,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 | |
| B. | pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,每生成1molFe3O4时,转移电子数为4NA | |
| B. | 常温常压下,2.24LCO2的质量大于4.4g | |
| C. | 常温下,1L0.1mol•L-1AlCl3溶液中阳离子数目小于0.1NA | |
| D. | 15.6gNa2O2和Na2S固体混合物中,含有阴离子数目大于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
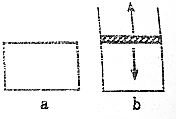 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.
欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤①⑥⑦④ | B. | ④⑥①③②⑤⑦ | C. | ④②⑤⑥①③⑦ | D. | ②⑥⑦④③⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液呈中性 | |
| B. | a≥b | |
| C. | 混合溶液中,c(A-)=c(Na+) | |
| D. | 混合液中水电离出c(OH-)大于该温度下纯水电离出c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com