
【题目】以铅蓄电池为电源.通过电解法制备酒石酸(C4H606,简写为RH2)的原理如图所示(A、B为惰性电极,a、b为离子交换膜)
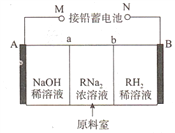
下列叙述不正确的是
A. N极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B. b为阴离子交换膜
C. 阴极反应为2H20+2e-=H2↑+20H-,阴极区溶液pH升高
D. 铅蓄电池中消耗2molH2SO4时,理论上生成2molRH2
【答案】D
【解析】电解目的为制备RH2,则装置右侧为产品室,若原料室中的R2-通过阴离子交换膜进入产品室与H+结合,则可制得RH2。所以B极应为H2O中的OH-放电,生成H+,即B极为阳极,电极反应为:2H2O-4e-= O2↑+4H+,b为阴离子交换膜,N为正极,M为负极,A为阴极。A、N为铅蓄电池正极,电极反应为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,故A正确;B、根据上述分析可知,b为阴离子交换膜,故B正确;C、阴极应为H2O中的H+放电,生成OH-,故电极反应为:2H20+2e-=H2↑+20H-,0H-浓度增大,pH增大,故C正确;D、铅蓄电池放电时总反应为:Pb+ PbO2+2H2SO4=2PbSO4+2H20,当电池中消耗2mol H2SO4时,则电路中转移2mol e-。根据B极电极反应2H2O-4e-= O2↑+4H+,可知,转移2mol e-,原料室有2mol H+生成,R2- +2H+= RH2,所以理论上可生成1mol RH2,故D错误。故选D。


科目:高中化学 来源: 题型:
【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
【答案】D
【解析】A、反应①为加成反应,没有副产物,则原子利用率为100%,选项A正确;B、反应②为碳碳双键发生的加聚反应,该反应为: ,选项B正确;C、相对分子质量为86,且与甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]具有相同官能团的有机物应该含有一个酯基和一个碳碳双键且碳原子数为4,有HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3COOCH=CH2、CH2=CHCOOCH3、HCOOC(CH3)=CH2共5种,选项C正确;D、甲基丙烯酸甲酯能被酸性高锰酸钾氧化而使其褪色,也能与溴发生加成反应而使Br2的CCl4溶液褪色,二者原理不相同,选项D不正确。答案选D。
,选项B正确;C、相对分子质量为86,且与甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]具有相同官能团的有机物应该含有一个酯基和一个碳碳双键且碳原子数为4,有HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3COOCH=CH2、CH2=CHCOOCH3、HCOOC(CH3)=CH2共5种,选项C正确;D、甲基丙烯酸甲酯能被酸性高锰酸钾氧化而使其褪色,也能与溴发生加成反应而使Br2的CCl4溶液褪色,二者原理不相同,选项D不正确。答案选D。
【题型】单选题
【结束】
4
【题目】按如图各装置进行实验能成功完成相应实验的是

A. 图1:证明非金属性强弱:C>Si B. 图2:制备氢氧化亚铁
C. 图3:分离碘并回收苯 D. 图4:制取和收集乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角。下列关于硅及其化合物的叙述错误的是
A.硅是制造太阳能电池的常用材料
B.二氧化硅是制造光导纤维的基本原料
C.硅胶可作食品干燥剂、抗氧化剂,可直接食用
D.氢氟酸能刻蚀玻璃,刻制各种精美的玻璃饰品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
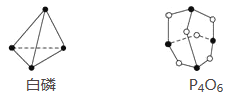
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。
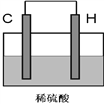
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是硫酸试剂标签上的部分内容,据此下列说法错误的是
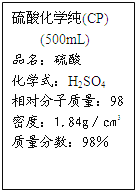
A. 该硫酸试剂的物质的量浓度为18.4mol/L
B. 该硫酸与等体积的水混合所得溶液的质量分数大于49%
C. 配制1.0mol /L的80mL 稀硫酸的实验过程中需要5mL量简、胶头滴管、100mL容量瓶等玻璃仪器
D. 一定条件下,将6.4gCu加入到足量该硫酸中可得到标准状况下的气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物理量与其相应的单位不匹配的是
A.摩尔质量:g /molB.气体摩尔体积:L/mol
C.物质的量:molD.物质的量浓度:L/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com