
分析 (1)根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;
(2)Cu、Au同族,最外层电子数相同,利用均摊法计算晶胞中含有的原子个数来确定原子个数之比,金属晶体中存在金属键;
(3)CaF2的结构如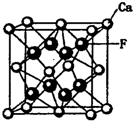 ,利用均摊法计算.
,利用均摊法计算.
解答 解:(1)SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化,故答案为:正四面体;sp3;
(2)铜是29号元素,其核外电子排布式是1s22s22p63s23p63d104s1,金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布为6s1;在晶胞中Cu原子处于面心,Au原子处于顶点位置,所以该晶胞中含有铜原子个数=6×$\frac{1}{2}$=3,金原子个数=8×$\frac{1}{8}$=1,则该合金中Cu原子与Au原子数量之比为3:1,金属晶体中作用力为金属键,
故答案为:6s1;3:1;金属键;
(3)CaF2的结构如图 ,将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,Cu原子处于面心,所以晶胞中Cu原子个数为3,Au原子处于顶点位置,所以晶胞中Au原子个数为1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,Cu原子处于面心,所以晶胞中Cu原子个数为3,Au原子处于顶点位置,所以晶胞中Au原子个数为1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
故答案为:Cu3AuH8.
点评 本题考查晶胞计算,为高频考点,把握杂化、电子排布、晶体作用力、均摊法计算等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:x>y>z | B. | 电负性:x>z>y | ||
| C. | 原子序数:y>z>x | D. | 第一电离能:z>y>x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
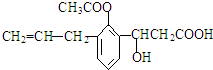 ,则此有机物可发生的反应类型有:( )①取代 ②加成 ③酯化 ④水解 ⑤氧化 ⑥中和.
,则此有机物可发生的反应类型有:( )①取代 ②加成 ③酯化 ④水解 ⑤氧化 ⑥中和.| A. | ①②④⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H2)保持不变 | |
| B. | c(H2)=c(I2) | |
| C. | 2v正(HI)=v逆(I2) | |
| D. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C2H4 | B. | CH3CH2Cl和CH3CH2CH2CCl3 | ||
| C. | CH3CH2CH3和C5H12 | D. | CH3CH2CH2OH和HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 | |
| B. | Cl2、SO2都能使紫色石蕊试液与品红溶液褪色 | |
| C. | 相同质量的Cu分别与过量的体积相同的浓硝酸、稀硝酸反应,反应中铜失去的电子数相等 | |
| D. | 32g Cu与50mL 18.4mol/L的硫酸溶液共热,充分反应后,被还原的H2SO4为0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
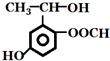
| A. | 1mol该有机物最多能与含2mol Br2的水溶液反应 | |
| B. | A的核磁共振氢谱图上有7个吸收峰 | |
| C. | A能发生银镜反应和酯化反应 | |
| D. | 与足量NaOH溶液反应转变成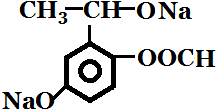 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯酸酯的单体的结构简式为:CH2=CH-COOR | |
| B. | 聚丙烯酸酯在一定条件下能发生加成反应 | |
| C. | 聚丙烯酸酯不能发生水解反应 | |
| D. | 聚丙烯酸酯有固定的熔沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com