

| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |
分析 A、溶液的酸性越强,则对水的电离抑制得越厉害;
B、加水稀释,弱电解质的电离平衡被促进;
C、乙中含有的氯离子对AgCl的溶解平衡有抑制作用;
D、乙烧杯中HCl的物质的量不明确.
解答 解:A、溶液的酸性越强,则对水的电离抑制得越厉害,由于乙烧杯中含有强电解质HCl,故乙烧杯中的酸性比甲强,则对水的电离的抑制更强,即乙中水的电离程度更小,水电离出OH-浓度:甲>乙,故A错误;
B、加水稀释,弱电解质的电离平衡被促进,故甲中氢离子浓度下降较乙中的慢,则pH变化甲<乙,故B错误;
C、乙中含有的氯离子对AgCl的溶解平衡有抑制作用,故相同条件,AgCl(s)在甲中溶解度大于在乙中,故C正确;
D、向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后,溶液中存在电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)+c(Cl-),但由于乙烧杯中HCl的物质的量不明确,故和加入的NaOH的物质的量是否相等无法确定,故所得溶液中c(Na+)不一定等于c(Cl-),故c(H+)=c(CH3COO-)+c(OH-)不一定成立,故D错误.
故选C.
点评 本题考查了弱电解质的电离平衡的移动和溶解平衡的移动等问题,综合性较强,难度适中,注意加水稀释对弱电解质的电离平衡的影响.


科目:高中化学 来源: 题型:解答题
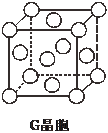 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
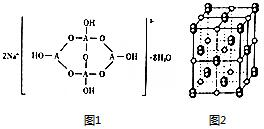 已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.
已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和. .
.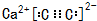 ,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).
,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用湿润的淀粉碘化钾试纸检验产物Q | |
| B. | K2FeO4在水中的电离方程式为K2FeO4→2K++Fe6++4O2一 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为1:3 | |
| D. | 反应中涉及的物质中有5种为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱主要成分为Na2CO3 | B. | 热的纯碱溶液去污效果更好 | ||
| C. | 纯碱有利于油污水解 | D. | 纯碱常用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10有三种同分异构体 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| C. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| D. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
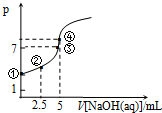 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )| A. | 水电离出的c(OH-):①点小于 ③点 | |
| B. | 此反应的滴定实验宜选用甲基橙做指示剂 | |
| C. | ②点时c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) | |
| D. | ④点时c(Na+)=c(N3-)+c(HN3)=$\frac{1}{15}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| B. | $\frac{{k}_{W}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:NH4+、Na+、SiO32-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
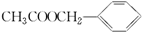 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: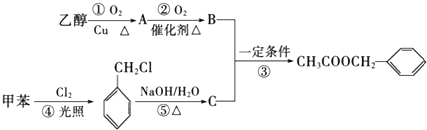
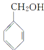 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基. ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com