
分析 (1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol-1;②NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol-1;目标反应的反应热为:①×2+②×2+③,由此分析解答;
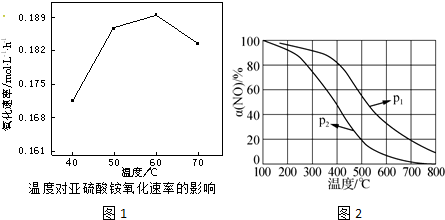
②根据图1分析,60℃氧化速率最快;
③根据2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H,该反应为熵减小的反应,则在一定条件下能自发进行是因为该反应为放热反应,根据平衡常数表达式计算K;
④根据题意恢复乙酸二氨合铜(I)溶液吸收CO的能力以供循环使用即使Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0平衡逆向移动,据此由平衡移动原理分析;
(2)温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;α(NO)几乎为0的原因是无二氧化氮,温度高于800℃时,NO2几乎完全分解.
解答 解:(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol-1;②NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol-1;目标反应的反应热为:①×2+②×2+③,
故答案为:2a+2b+c;
②根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,
故答案为:60℃;
③根据2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H,该反应为熵减小的反应,则在一定条件下能自发进行是因为该反应为放热反应,即△H<0;根据题给数据,初始浓度为c(NH3)=$\frac{4mol}{100L}$=0.04mol/L,c(CO2)=$\frac{2mol}{100L}$=0.02mol/L,则
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g),
初始(mol/L) 0.04 0.02 0
转化(mol/L) 0.02 0.02×50% 0.01
平衡(mol/L) 0.02 0.01 0.01
则平衡常数K=$\frac{0.01}{{0.02}^{2}×0.01}$=2500,
故答案为:△H<0;2500;
④根据题意恢复乙酸二氨合铜(I)溶液吸收CO的能力以供循环使用即使Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0平衡逆向移动,该反应正向为放热、气体体积缩小的反应,根据平衡移动原理升温或减压平衡逆向移动,
故答案为:B;
(2)温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,温度高于800℃时,NO2几乎完全分解;
故答案为:>;温度高于800℃时,NO2几乎完全分解.
点评 本题考查盖斯定律的应用、依据图象分析平衡移动的原因及平衡常数的计算,考查范围广,难度中等.


科目:高中化学 来源: 题型:选择题
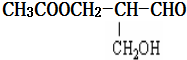
| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 在铜作催化剂与氧气加热反应 | D. | 在催化剂存在下与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 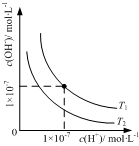 表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1 | |
| C. | 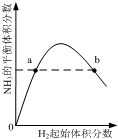 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 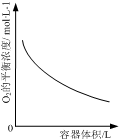 表示同一温度下,在不同容积的容器中进行反应2NO2(g)?2NO(g)+O2(g),O2的平衡浓度与容器容积的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
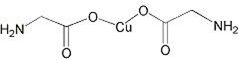 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com