
某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为: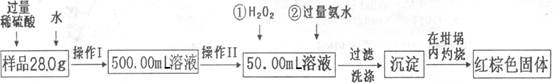
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有 (填仪器名称)。
(2)操作II中必须用到的仪器是 。
| A.50mL量筒 | B.100mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |
(16分)(1)500mL容量瓶(2分) (2)C(2分)
(3)2Fe2++H2O2+2H+=2Fe3++2H2O(3分)
(4)取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净(2分)
(5)继续加热,冷却至室温、称量,直至两次连续称量质量差不0.1g(2分)
(6)55.0%(3分) (7)不可行(2分)
解析试题分析:(1)根据配制一定物质的量浓度溶液的方法可知,配制500.00mL溶液先后需要烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管等仪器;(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,Fe2O3+3H2SO4(过量)=Fe2(SO4)3+3H2O,硫酸铁、硫酸亚铁和硫酸的混合溶液显酸性,量取50.00mL酸性溶液应该选择50mL酸式滴定管,故只有C正确;(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁,根据化合价升降总数、电荷总数、原子个数守恒可知:2Fe2++H2O2+2H+=2Fe3++2H2O;(4)H++NH3?H2O= H2O +NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,由于SO42―+Ba2+=BaSO4↓,因此常用可溶性钡盐溶液检验SO42―是否洗涤干净;(5)2Fe(OH)3 Fe2O3+3H2O,若b1、b2几乎相等,说明Fe(OH)3沉淀几乎完全分解为Fe2O3固体,若b1—b2=0.3,说明Fe(OH)3沉淀没有彻底分解,因此需要对盛有Fe(OH)3沉淀的坩埚进行多次加热、在干燥器中冷却、称量并记录质量,直至称量质量几乎相等;(6)先求氧化铁的质量,m(Fe2O3)=44.8g—42.6g=2.2g;再求铁元素的质量,Fe2O3=2Fe+3O,则m(Fe)= m(Fe2O3)×112/160=(44.8g—42.6g)×112/160;根据铁元素质量守恒可知,50.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160,则500.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;最后求样品中铁元素的质量分数,w(Fe)=" m(Fe)/" m(样品)×100%=(44.8g—42.6g)×112/160×500.00mL/50.00mL÷28.0g×100%=55.0%;(7)样品中Fe2O3难溶于水,FeSO4易溶于水,加热能促进FeSO4水解生成Fe(OH)2、H2SO4,Fe(OH)2易被氧化为Fe(OH)3,H2SO4难挥发,Fe(OH)3与H2SO4易发生中和反应生成Fe2(SO4)3、H2O,蒸干灼烧不能使Fe2(SO4)3溶液分解为Fe2O3,故该方案不可行。
Fe2O3+3H2O,若b1、b2几乎相等,说明Fe(OH)3沉淀几乎完全分解为Fe2O3固体,若b1—b2=0.3,说明Fe(OH)3沉淀没有彻底分解,因此需要对盛有Fe(OH)3沉淀的坩埚进行多次加热、在干燥器中冷却、称量并记录质量,直至称量质量几乎相等;(6)先求氧化铁的质量,m(Fe2O3)=44.8g—42.6g=2.2g;再求铁元素的质量,Fe2O3=2Fe+3O,则m(Fe)= m(Fe2O3)×112/160=(44.8g—42.6g)×112/160;根据铁元素质量守恒可知,50.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160,则500.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;最后求样品中铁元素的质量分数,w(Fe)=" m(Fe)/" m(样品)×100%=(44.8g—42.6g)×112/160×500.00mL/50.00mL÷28.0g×100%=55.0%;(7)样品中Fe2O3难溶于水,FeSO4易溶于水,加热能促进FeSO4水解生成Fe(OH)2、H2SO4,Fe(OH)2易被氧化为Fe(OH)3,H2SO4难挥发,Fe(OH)3与H2SO4易发生中和反应生成Fe2(SO4)3、H2O,蒸干灼烧不能使Fe2(SO4)3溶液分解为Fe2O3,故该方案不可行。
考点:考查化学实验和工艺流程题,涉及溶液配置、仪器使用、除杂原理、沉淀洗涤、数据处理、实验方案的设计和评价等问题。


科目:高中化学 来源: 题型:填空题
Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:
(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A—→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。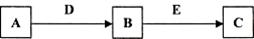
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业生产纯碱的工艺流程示意图如下: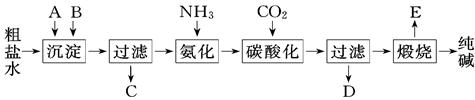
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式A. ,B.
(2)实验室提纯粗盐的实验操作依次为:取样、 、沉淀、 、 、冷却结晶、 、烘干
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是 .碳酸化时没有析出碳酸钠晶体,其原因是
(4)碳酸化后过滤、滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法是
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方式程为 ,滤液D加石灰水前先要加热,原因是
(6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为 (注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答: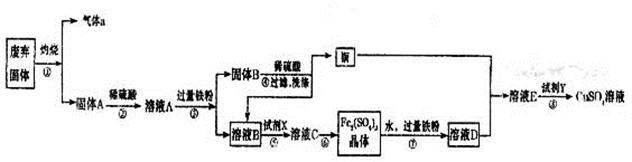
(1)气体a的化学式为 。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式 。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为 。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意 。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g) △H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)
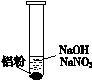
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
| 装 置 | 现 象 |
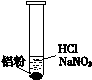 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
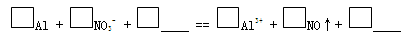
| 装 置 | 现 象 |
 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: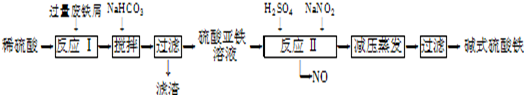
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
步骤一:废铜屑制硝酸铜
如图,
用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是 ,
用该装置制取硝酸铜,好处是 。
(2)步骤二中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外);洗涤的目的是 。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→ Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为 g,化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com