

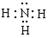
 Li3N + 2NH3↑
Li3N + 2NH3↑ C2H5 OLi + NH3可将其销毁。
C2H5 OLi + NH3可将其销毁。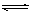 LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。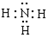
 Li3N + 2NH3↑。
Li3N + 2NH3↑。 C2H5OLi + NH3,可将其销毁。”这里必须注意,应回答的是解释其化学原理,而不是解释其原因。
C2H5OLi + NH3,可将其销毁。”这里必须注意,应回答的是解释其化学原理,而不是解释其原因。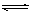 LiCl (s) + H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl﹒H2O(S)
LiCl (s) + H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl﹒H2O(S)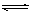 LiCl (s) + H2O(g)向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g)向正方向移动,有利于无水LiCl的制备。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在1 L 0.1 mol/L硫化钠溶液中阴离子总数大于0.1NA |
| B.1 mol O2作氧化剂时转移电子数一定为4NA |
| C.标准状况下,22.4 L戊烷所含分子数为NA |
| D.在1 L 1.0 mol/L NaCl溶液中含有NA个NaCl分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.x=2.24 |
| B.钠的物质的量为0.2 mol |
| C.反应时,Na、Mg、Al均过量 |
| D.曲线b为Mg与盐酸反应的图像 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K2SO4·Cr2(SO4)3 | B.2K2SO4·Cr2(SO4)3 |
| C.K2SO4·2Cr2(SO4)3 | D.K2SO4· Cr2(SO4)3 Cr2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 L1 mol/L氯化铜溶液中含有NA个Cu2+ |
| B.标准状况下,22.4 L O2参加任何化学反应转移的电子数都是4NA |
| C.1 mol Zn与足量稀HNO3反应,转移2NA个电子 |
| D.1 mol H3O+所含电子数为8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com