

| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
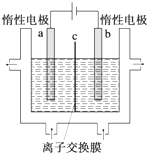 碘及其化合物在人类活动中占有重要地位.
碘及其化合物在人类活动中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求完成下列问题
按要求完成下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的氨水可以使酚酞试液变红 |
| B、0.1mol/L的氯化铵溶液的pH约为5 |
| C、氨水溶液的导电性比强碱溶液弱 |
| D、铵盐受热易分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com