
| A. | CaCl2和Na2CO3 | B. | 稀盐酸和Na[Al(OH)4] | C. | 稀盐酸和Na2CO3 | D. | NaOH和AlCl3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
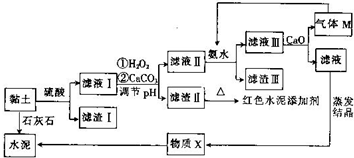 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫(SO2) | B. | 总悬浮颗粒物(TSP) | C. | 二氧化氮(NO2) | D. | 二氧化碳(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com