

 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子) .
. .
. .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).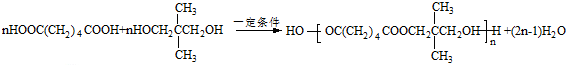 .
.
 .
.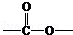 基团
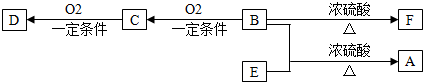
基团 分析 由合成图可知,环己烷与氯气光照下发生取代反应生成A,A分子中只有一个氯原子,则A为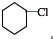 ,然后发生消去反应生成B为
,然后发生消去反应生成B为 ,再被氧化生成C为HOOCCH2CH2CH2CH2COOH,D能发生银镜反应,且分子中有支链,则D为
,再被氧化生成C为HOOCCH2CH2CH2CH2COOH,D能发生银镜反应,且分子中有支链,则D为 ,结合信息②可知,D与HCHO反应生成E为
,结合信息②可知,D与HCHO反应生成E为 ,E与氢气发生加成生成F为
,E与氢气发生加成生成F为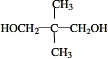 ,C与F发生酯化反应生成PNA为
,C与F发生酯化反应生成PNA为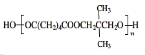 ,据此解答.
,据此解答.
解答 解:由合成图可知,环己烷与氯气光照下发生取代反应生成A,A分子中只有一个氯原子,则A为 ,然后发生消去反应生成B为
,然后发生消去反应生成B为 ,再被氧化生成C为HOOCCH2CH2CH2CH2COOH,D能发生银镜反应,且分子中有支链,则D为
,再被氧化生成C为HOOCCH2CH2CH2CH2COOH,D能发生银镜反应,且分子中有支链,则D为 ,结合信息②可知,D与HCHO反应生成E为
,结合信息②可知,D与HCHO反应生成E为 ,E与氢气发生加成生成F为
,E与氢气发生加成生成F为 ,C与F发生酯化反应生成PNA为
,C与F发生酯化反应生成PNA为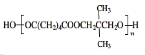 ,
,
(1)A为 ,然后发生消去反应生成B为
,然后发生消去反应生成B为 ,反应方程式为
,反应方程式为 ,
,
故答案为: ;
;
(2)C为HOOCCH2CH2CH2CH2COOH,官能团名称为羧基,故答案为:羧基;
(3)D能发生银镜反应,且分子中有支链,则D为 ,故答案为:
,故答案为: ;
;
(4)E与氢气发生加成生成F为 ,故答案为:加成反应(或还原反应);
,故答案为:加成反应(或还原反应);
(5)E为 ,含有羟基和醛基,若一次取样,检验E中所含官能团,需先用活泼金属Na检验羟基,再用银氨溶液(或新制的Cu(OH)2悬浊液)检验醛基,故答案为:
,含有羟基和醛基,若一次取样,检验E中所含官能团,需先用活泼金属Na检验羟基,再用银氨溶液(或新制的Cu(OH)2悬浊液)检验醛基,故答案为: ;Na、银氨溶液(或新制的Cu(OH)2悬浊液);
;Na、银氨溶液(或新制的Cu(OH)2悬浊液);
(6)由C和F合成PNA的化学方程式是: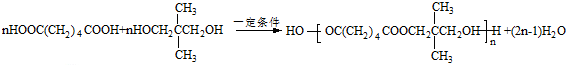 ,
,
故答案为: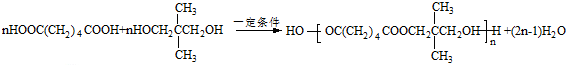 ;
;
(7)①香豆素是一种重要的香料,与C具有相同的相对分子质量,相对分子质量为146,14.6g香豆素完全燃烧生成39.6g CO2和5.4g H2O,即0.1mol香豆素燃烧生成0.9molCO2和0.3molH2O,再由质量守恒可知,含有氧原子的物质的量为$\frac{14.6g-0.9mol×12g/mol-0.6g}{16g/mol}$=0.2mol,所以香豆素的分子式是C9H6O2,故答案为:C9H6O2;
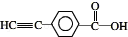
②香豆素的同分异构体符合a.分子中含有 基团;b.分子中除一个苯环外,无其他环状结构;c.苯环上的氢原子被氯原子取代,得到两种一氯代物,
基团;b.分子中除一个苯环外,无其他环状结构;c.苯环上的氢原子被氯原子取代,得到两种一氯代物,
则其同分异构体的结构简式为
 ,故答案为:
,故答案为:
 .
.
点评 本题考查有机物的推断与合成,注意根据有机物的结构和反应条件推断,需要学生对给予的信息进行利用,熟练掌握官能团的性质与转化,较好的考查学生自学能力与知识迁移运用,是有机题目常见题型,难度中等.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述反应可知氧化性HNO3>Fe3+>稀硫酸 | |
| C. | 上述过程中,会产生一种无色、难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则通入的SO2和逸出的气体物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
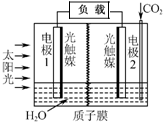 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O+2F2═4HF+O2 | B. | H2O+3NO2═2HNO3+NO | ||
| C. | 3H2O+P2O5═2H3PO4 | D. | H2O+Si+2NaOH═2H2↑+Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).| 气化炉 | 燃烧炉 |
| ①C(s)+H2O(g)?CO(g)+H2(g)△H=+131.6kJ•mol-1 ②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1 ③CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ•mol-1 | ④C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 ⑤CaCO3(s)?CaO(s)+CO2(g) K |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| T1 | 0 | 1.5 | 2.3 | 4.0 | 4.0 | 4.0 |
| T2 | 0 | 1.0 | 1.8 | 2.8 | 3.1 | 3.1 |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| p1 | 1 | 0.90 | 0.83 | 0.75 | 0.75 | 0.75 |
| p2 | 1 | 0.58 | 0.35 | 0.31 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
分子式为C5H11Cl的同分异构体有( )
A.3种 B.5种 C.8种 D.9种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com