
| A��ʹ�û��β�������Ϊ�˼ӿ췴Ӧ���ʣ���Сʵ����� |
| B��Ϊ��ȷ�ⶨ��Ӧ�����Һ���¶ȣ�ʵ�����¶ȼ�ˮ����Ӧ��С�ձ��ײ��Ӵ� |
| C����0.5mol��L��1NaOH��Һ�ֱ���0.5 mol��L��1�����ᡢ������Һ��Ӧ������ȡ����Һ�����ȣ����õ��к�����ֵ��ͬ |
| D���ڲⶨ�к���ʵ������Ҫʹ�õ������У���ƽ����Ͳ���ձ����ζ��ܡ��¶ȼ� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���| T�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

 ���������ڻ��������ܶ� �����������С�����䡱��������ƽ����Է������� �����������С�����䡱����
���������ڻ��������ܶ� �����������С�����䡱��������ƽ����Է������� �����������С�����䡱�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������b-a�� kJ��mol��1 | B��+��b-a�� kJ��mol��1 |
| C��(b-a) kJ��mol��1 | D��(b+a)kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪2H2(g)+O2(g) ==2H2O(l)����H=��571.6kJ��mol-1����H2��ȼ����Ϊ285.8kJ��mol-1 |
| B����֪4P�����ף�s��="=" P4�����ף�s������H>0������ױȺ����ȶ� |
| C����20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ�� NaOH(aq)+CH3COOH(aq) ="=" CH3COONa(aq) + H2O(l) ��H =��57.4kJ��mol-1 |
| D����֪2C(s)+2O2(g)=2CO2(g) ��H1��2C(s)+O2(g)="2CO(g)" ��H2�����H1>��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ʱ�Ϊ��ֵ�ķ�Ӧ�������ȷ�Ӧ |
| B�����ȵ������ӷ�Ӧһ�����Է����� |
| C��ͬһ�����£���ˮ�����ʵ���Ũ�Ȳ�ͬ����Һ�У������̶��Dz���ͬ�� |
| D��ǿ����ʶ������ӻ����������ʶ��ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3��g�� ��H="-197" kJ��mol-1����ͬһ�¶Ⱥ�ѹǿ�£���ij�ܱ�������ͨ��2 mol SO4��1 mol O2�ﵽƽ��ʱ����Ӧ�ų�������ΪQ1������һ��ͬ���ܱ�������ͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�������ΪQ2�����й�ϵ��ȷ���ǣ� ��
2SO3��g�� ��H="-197" kJ��mol-1����ͬһ�¶Ⱥ�ѹǿ�£���ij�ܱ�������ͨ��2 mol SO4��1 mol O2�ﵽƽ��ʱ����Ӧ�ų�������ΪQ1������һ��ͬ���ܱ�������ͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�������ΪQ2�����й�ϵ��ȷ���ǣ� ��A��Q2=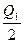 | B��Q2��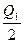 ="197" kJ ="197" kJ | C��Q2��Q1��197 kJ | D��Q1=Q2="197" kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�ֽ������������ | B��������� |
| C������������������������� | D��ϡ�����ϡ����������Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������¶ȣ�һ���ʹ����ӵİٷ������������Ӧ�������� |
| B�������֮�䷢������ײһ��Ϊ��Ч��ײ |
| C���ɱ�������һ�����У���S��0 |
D�����ڷ�Ӧ��CO (g)+H2O (g)  CO2 (g)+H2 (g)������ʱ���¶����ߣ�H2Ũ�������������Ӧ���ʱ�Ϊ��ֵ CO2 (g)+H2 (g)������ʱ���¶����ߣ�H2Ũ�������������Ӧ���ʱ�Ϊ��ֵ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com