
| A、滴人甲基橙显红色的溶液中:NH4+、Ba2+、AlO-2、Cl- | ||||
B、Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、Si
| ||||
C、含有较多S
| ||||
D、澄清透明溶液中:K+、Mn
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、碳酸钙和盐酸反应:C
| ||
| B、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | ||
| C、将氯气通入氯化亚铁溶液中:2Fe2++Cl2═2Fe3++2Cl- | ||
D、碳酸氢钠溶液与盐酸反应:C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
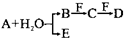
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- | ||
B、c(H+)=
| ||
| C、澄清透明的溶液中:Cu2+、NH4+、NO3-、ClO4- | ||
| D、使红色石蕊试纸变蓝的溶液中:CH3COO-、HCO3-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Cl-、NO3-、Na+ |
| B、Fe3+、K+、I-、Cl- |
| C、Al3+、SO42-、K+、Cl- |
| D、Ba2+、HCO3-、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)mol?L-1 | c(CO2)mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正) |
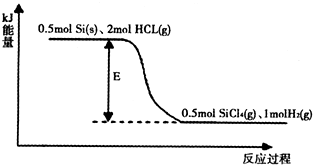
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Fe2+、SO42- |
| B、Ba2+、NH4+、Br- |
| C、Al3+、HCO3-、Cl- |
| D、Na+、SiO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中c(K+)为2 mol?L-1 |
| B、上述电解过程中共转移4 mol电子 |
| C、电解得到的Cu的物质的量为0.5 mol |
| D、电解后溶液中c(H+)为2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、化合物Y2M4、M2Z2均只含有极性键 |
| C、最高价氧化物对应水化物的酸性:Y>X |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com