
| A. | 过氧化钠既是氧化剂又是还原剂 | |
| B. | 3摩尔过氧化钠发生反应,有12摩尔电子转移 | |
| C. | 在高铁酸钠中铁为+4价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钠既是氧化产物又是还原产物 |
分析 Fe2O3+3Na2O2=2Na2FeO4+Na2O中,Fe元素的化合价由+3价升高为+6价,O元素的化合价由-1价降低为-2价,以此来解答.
解答 解:A.过氧化钠中,O元素的化合价降低,为氧化剂,故A错误;
B.当有3molNa2O2参加反应则有3mol×2×[-1-(-2)]=6mole-发生转移,故B错误;
C.在高铁酸钠中,铁的化合价为+6价,具有强氧化性,能杀菌消毒,故C错误;
D.Fe元素的化合价升高,O元素的化合价降低,则高铁酸钠既是氧化产物,又是还原产物,故D正确;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念和转移电子数的考查,注意从化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
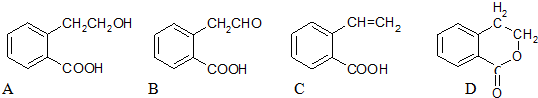

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
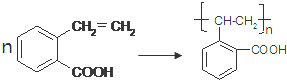
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
| B | 用Cu作电极电解NaCl溶液,阳极的电极反应式: 2Cl--2e-═Cl2↑ | 正确; Cl-优先于OH-放电 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-═HClO+HSO | 正确; H2SO3的酸性强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2-+2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | 正确; Mg(OH)2比MgCO3更难溶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
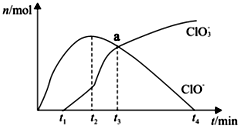 工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )
工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )| A. | HClO具有强氧化性,而NaClO没有氧化性 | |
| B. | 向漂白液中加入足量浓盐酸可增强漂白效果 | |
| C. | 无法求出a点时的溶液中,c( Na+ )和 c(Cl-)的比值 | |
| D. | t 2到t 4,n( ClO - )下降的原因可能是:3ClO -═2Cl-+ClO 3 - |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn电极上发生的反应为:2H++2e-═H2↑ | |
| B. | H+向Zn电极移动 | |
| C. | 溶液的c(H+)减小 | |
| D. | 电子由Cu转移到Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | amol | B. | bmol | C. | (3a-b)mol | D. | (a+b)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com