
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
科目:高中化学 来源: 题型:
【题目】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) ![]() 2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
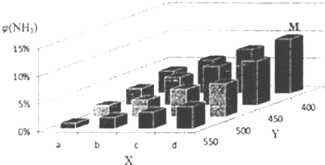
回答下列问题:
(1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g) ![]() 2NH3(l)△H2;则反应N2(g)+3H2(g)
2NH3(l)△H2;则反应N2(g)+3H2(g) ![]() 2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示);
2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示);
(2)合成氨的平衡常数表达式为____________,平衡时,M点NH3的体积分数为10%,则N2的转化率为____________(保留两位有效数字) ;
(3)X轴上a点的数值比b点____________(填“大”或“小”)。上图中,Y轴表示____________(填“温度”或“压强”),判断的理由是____________;
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
Ⅰ | 恒温恒容 | 放热Q1kJ |
Ⅱ | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
下列判断正确的是____________;
A.放出热量:Ql<Q2<△Hl B.N2的转化率:Ⅰ>Ⅲ
C.平衡常数:Ⅱ>Ⅰ D.达平衡时氨气的体积分数:Ⅰ>Ⅱ
(5)常温下,向VmL amol/L的稀硫酸溶液中滴加等体积bmol/L的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)____________c(SO42-)(填“>”、“<”或“=”) ;
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-,写出负极的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
I.利用下列装置制备NaNO2
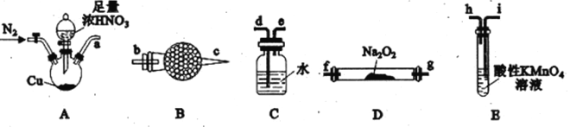
已知:①2NO+Na2O2=2NaNO2;②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为__________,装置C的作用是__________。
(4)装置E中发生反应的离子方程式为____________________。
Ⅱ.测定上述实验所制备的NaNO2样品(含NaNO3杂质)的纯度。称量D中所得样品ag溶解后配制成250mL溶液取25.00mL于锥形瓶中,用bmoL-1酸性高锰酸钾溶液滴定到终点。重复上述滴定操作两次,测得数据如下表:
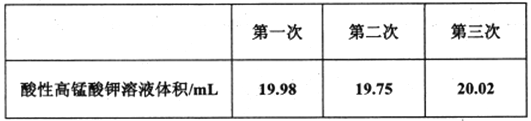
(5)滴定终点的实验现象为_________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是__________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2的质量分数为__________(用含a、b的关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。
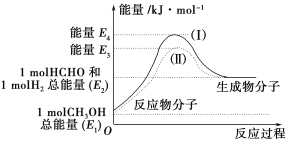
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是_______________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
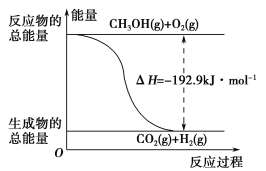
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是
A.Fe3+、Cu2+、Cl-、NO3—B.H+、Na+、AlO2—、CO32—
C.Ca2+、Fe2+、SO42—、ClO-D.Mg2+、NH4+、OH-、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是 ( )
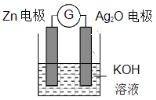
A. 放电过程中,负极质量会增加
B. Ag2O 电极发生还原反应
C. Zn 电极的电极反应式:Zn-2eˉ+2OHˉ=Zn(OH)2
D. 放电前后电解质溶液的碱性保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com