
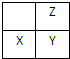
 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、维生素都是极易溶于水 |
| B、服用维生素越多对人体越有好处 |
| C、维生素C怕高温,加热时间过长会破坏 |
| D、牙齿发黄,掉渣是因为缺少维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钪是一种金属元素,产量较少 |
| B、钪的化学性质不活泼 |
| C、银白色和质软是钪的物理性质 |
| D、稀土矿是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| B、验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| C、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| D、某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ |
| C、将少量硝酸银溶液滴入氨水中:Ag++2NH3?H2O═[Ag(NH3)2]++2H2O |
| D、碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝是地壳里含量最多的金属元素 |
| B、在常温下,铝不能与氧气反应 |
| C、铝是一种比较活泼的金属 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com