ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���壮
��1��WԪ�������ڱ��е�λ��Ϊ
�������ڵ�V��A��
�������ڵ�V��A��
��д��YԪ��ԭ�ӵļ۵����Ų�ʽ��
2S22P3
2S22P3
��
��2����X��Z��Ԫ�ؿ������A��B���ֻ����A��һ�������¿��Էֽ��B��A�ķ�������
����
����
������ԡ������Ǽ��ԡ������ӣ�
��3��һ�������£�Y�ĵ���������X�ĵ��������ַ�Ӧ����6.8g C���壨��֪n��X����n��Y��=3��1���ɷų�18.44kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ
N
2��g��+3H
2��g��

2NH
3��g����H=-92.2kJ/mol
N
2��g��+3H
2��g��

2NH
3��g����H=-92.2kJ/mol
��
��4����X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����D
����֪1mol D��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壮д������������D��NaOH��Һ��Ӧ�����ӷ���ʽ
��
����֪D���������ᷴӦ����������ˮ��Ӧ��д��D����ˮ��Ӧ�����ӷ���ʽ
SO32-+Cl2+H2O�TSO42-+2Cl-+2H+
SO32-+Cl2+H2O�TSO42-+2Cl-+2H+
��
��5 ��X�ĵ�����Z�ĵ�����KOH��Ũ��Һ�п����γ�ԭ��أ�����Խ���M�ͽ���NΪ���Ե缫���ڵ�ص�M��ͨ��X�ĵ������壬N��ͨ��Z�ĵ������壬��M���ĵ缫��ӦʽΪ
H2+2OH--2e-�T2H2O
H2+2OH--2e-�T2H2O
��

 2NH3��g����H=-92.2kJ/mol
2NH3��g����H=-92.2kJ/mol 2NH3��g����H=-92.2kJ/mol
2NH3��g����H=-92.2kJ/mol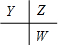 ����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�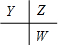 ����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����XΪ��Ԫ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
����Y��ԭ������Ϊa����Z��ԭ������Ϊa+1��W��ԭ������Ϊa+9������a+a+1+a+9=32-1�����a=7����XΪ��Ԫ�أ�YΪ��Ԫ�أ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ� 2NH3 ��g����H=-92.2 kJ/mol��
2NH3 ��g����H=-92.2 kJ/mol�� 2NH3 ��g����H=-92.2 kJ/mol��
2NH3 ��g����H=-92.2 kJ/mol��


 H2SO3��H2SO3
H2SO3��H2SO3 H++HSO3-
H++HSO3- H2SO3��H2SO3
H2SO3��H2SO3 H++HSO3-
H++HSO3-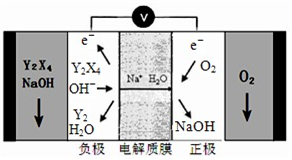
 X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����
X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����