




科目:高中化学 来源:不详 题型:计算题
 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
| A.容器中压强不变 | B.体系的密度不随时间改变 |
| C.v正(H2)=2v逆(CH3OH) | D.CO与H2的物质的量的比不随时间改变 |
 CH3OH(g)的化学平衡常数K= 。
CH3OH(g)的化学平衡常数K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ΔH<0,ΔS>0,所有温度下反应自发进行 |
| B.ΔH>0,ΔS>0,所有温度下反应自发进行 |
| C.ΔH<0,ΔS<0,低温下反应自发进行 |
| D.ΔH>0,ΔS<0,所有温度下反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.这是一个放热反应 | B.该反应可能需要加热 |
| C.生成物的总能量低于反应物的总能量 | D.反应物比生成物更稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g)+
H2(g)+ I2(g)=HI(g) △H=-4.5 kJ?mol-1的叙述正确的是( )
I2(g)=HI(g) △H=-4.5 kJ?mol-1的叙述正确的是( )| A.1mol H2和1mol I2完全反应放出4.5kJ热量 |
| B.1个氢分子和1个碘分子完全反应放出9kJ热量 |
| C.1mol H2和1mol I2完全反应生成气态HI放出9kJ热量 |
| D.0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Be+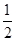 O2===BeO ΔH=-564.3 kJ·mol-1 O2===BeO ΔH=-564.3 kJ·mol-1 |
B.Be(s)+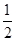 O2(g)===BeO(s)ΔH=+564.3 kJ·mol-1 O2(g)===BeO(s)ΔH=+564.3 kJ·mol-1 |
C.Be(s)+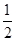 O2(g)===BeO(s)ΔH=-564.3 kJ·mol-1 O2(g)===BeO(s)ΔH=-564.3 kJ·mol-1 |
D.Be(s)+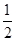 O2(g)===BeO(g) ΔH=-564.3 kJ O2(g)===BeO(g) ΔH=-564.3 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝与稀盐酸的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与二氧化碳的反应 | D.甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com