
 .
.
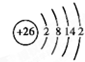
分析 (1)铁为26号元素,根据核外电子排布规律画出原子结构示意图;
(2)同周期自左而右电负性增大,同主族自上而下电负性减小;
(3)①(NH4)3FeF6是离子化合物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键;
②SCN-中各原子最外层均满足8电子稳定结构,所以该原子团的结构式为[S=C=N]-;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体;
(5)①a.非金属性越强,氢化物的稳定性越强;
b.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高;
c.非金属性越强与氢元素形成的共价键越强,键能越大;
d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大;
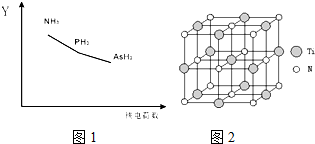
②根据均摊法计算晶胞中碳、氮、钛原子数目,进而确定化学式.
解答 解:(1)铁为26号元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)同周期自左而右电负性增大,同主族自上而下电负性减小,所以氟、氧、砷三种元素中电负性值由大到小的顺序是:F>O>As,故答案为:F>O>As;
(3)①(NH4)3FeF6是离子化合物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,故答案为:ad;
②SCN-中各原子最外层均满足8电子稳定结构,该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,故答案为:sp;1:1;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体,分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,故答案为:FeCl3是分子晶体,FeF3是离子晶体;
(5)①a.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;
b.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,故b错误;
c.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能随原子序数的增大而减小,故c正确;
d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故d错误,
故答案为:ac;
②利用均摊法可知,晶胞中含有碳原子数为8×$\frac{1}{8}$=1,含有氮原子数为6×$\frac{1}{2}$=3,含有钛原子数为12×$\frac{1}{4}$=4,所以碳、氮、钛原子数之比为1:3:4,则化合物的化学式为Ti4CN3,故答案为:Ti4CN3.
点评 本题是对物质结构的考查,涉及核外电子排布、电负性、化学键、杂化方式、晶体类型与性质、晶胞的计算,题目综合性较强,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C18H18O5 | B. | C18H24O4 | C. | C18H26O5 | D. | C18H28O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ①②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | E1-E2=△H | |
| B. | 该反应为吸热反应 | |
| C. | 升高温度,不影响活化分子百分数 | |
| D. | 使用催化剂使该反应的反应热发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的核外电子数相等 | ||
| C. | 241Am与243Am是同种核素 | D. | 241Am与243Am的化学性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com