
用下列装置进行相应实验,能达到实验目的的是
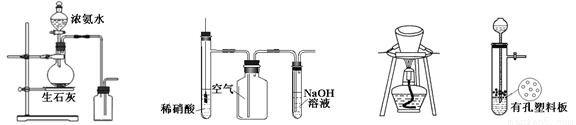
图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(三)化学试卷(解析版) 题型:选择题
工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g)  CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | bkJ | ckJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二3月月考化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的戊烷所含的分子数大于0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一下学期3月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸钙与盐酸反应:CO32-+2H+===H2O+CO2↑
B.硫酸氢钠溶液中加入足量的烧碱溶液:HSO4-+OH-=== SO42-+H2O
C.过氧化钠与水反应:2O22-+2H2O===4OH- + O2↑
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一下学期3月月考化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是
A. 净水剂明矾的化学式:BaSO4 B. C1-的结构示意图:
C. NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- D. 原子核内有18个中子的氯原子: 
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(四)化学 试卷(解析版) 题型:简答题
A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族。请回答下列相关问题(涉及元素的请用对应的元素符号冋答)
(1)①B、C、D第一电离能由大到小的顺序为______________。
②基态E原子外围电子排布式是_______________。
(2)DC2分子中D原子轨道的杂化类型为__________。与DC2互为等电子体的一种阴离子的化学式:_________。
(3)lmol(AB)2(直线形分子)中含有∏键的数目为____________。
(4)C和E能形成晶胞如图所示的甲、乙两种化合物。
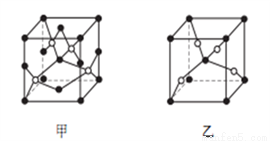
①甲的化学式为__________。
②高温时甲易转化为乙的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(四)化学 试卷(解析版) 题型:选择题
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
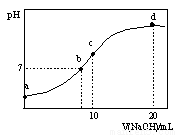
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(六)化学试卷(解析版) 题型:简答题
工业上利用软锰矿(主要成分为MnO2)用来制备“锰白”(MnCO3)和电极材料锰酸锂(LiO2·2MnO2·Mn2O3),期其工艺流程如下:

(1)“浸出”过程中SO2作用是__________。
(2)为使原料充分利用,滤液中c(Mn2+)应当小于__________mol·L-1。已知:常温下MnCO3的Kap=9.0×10-12。
(3)写出软锰矿与Li2CO3发生“高温还原”的化学方程式:____________。
(4)锰酸锂((LiO2·2MnO2·Mn2O3,M=362g· mol-1)中掺入LiMnO2能大幅提高电容量,实验室测定某电极材料中两者配比的操作步骤如下;准确称取2.012g的试样于锥形瓶中,加入5mL稀硫酸充分溶解;向上述所得溶液中加入10.00mL2.000mol·L-1草酸钠(Na2C2O4)标准溶液,搅拌至溶液清亮,并定容至250mL;从容量瓶中取出25.00mL溶液,用0.01mol·L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液20.00mL。通过计算两者物质的量之比_____(写出计算过程)。
已知实验中设计的相关氧化还原反应如下:
①Mn2++C2O42-→Mn2++2CO2↑
②Mn4++C2O42-→Mn2++2CO2↑
③MnO4-+C2O42-+H+→Mn2++2CO2↑(均未配平)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com