
| A. | 生成42.0 L N2(标准状况) | |
| B. | 转移电子的物质的量为1.25 mol | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,据此分析解答.
解答 解:10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,
A.生成2molN2,在标准状况下的体积为44.8L,故A错误;
B.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故B正确;
C.由反应可知,被还原的硝酸钾的物质的量为2mol×$\frac{2}{16}$=0.25mol,故C错误;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为$\frac{1.25×30}{10}$mol=3.75mol,故D正确;
故选BD.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查分析计算能力,明确氧化产物和还原产物关系是解本题关键,注意叠氮化钠中N元素化合价,为易错点.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+ 1s22s22p63s2 | B. | F 1s22s22p5 | ||
| C. | O2- 1s22s22p6 | D. | Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
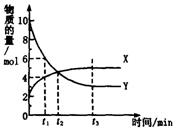 一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | 根据t2时的数据,可求出该温度下的平衡常数 | |
| D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在受热条件下,HD能还原氧化铜 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种非金属单质 | |
| D. | 是一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体在熔化状态下能导电 | |
| B. | 在晶体中只要有阴离子就一定有阳离子 | |
| C. | 原子晶体中一定有非极性共价键 | |
| D. | 分子晶体中不一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
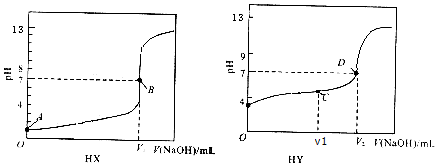
| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
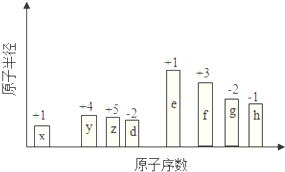 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.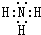 .位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.
.位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com