


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCN)>c(CN-) |
| B、c(Na+)>c(CN-) |
| C、c(HCN)-c(CN-)=c(OH-) |
| D、c(HCN)+c(CN-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
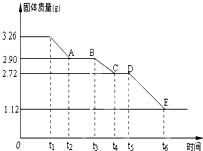 (1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:
(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
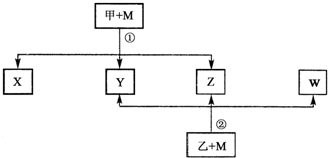
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:
如图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:查看答案和解析>>
科目:高中化学 来源: 题型:
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4L N2含有14NA个质子 |
| B、1L 1mol?L-1的盐酸中有NA个Cl- |
| C、标准状况下,36g含有D2O中含有个2NA分子 |
| D、1mol Na被完全氧化生成Na2O2,失去个2NA电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com