
从实验测得不同物质中O—O之间的键长和键能的数据如下表:
| O—O键 数据 | O | O | O2 | O |
| 键长/(10-12m) | 149 | 128 | 121 | 112 |
| 键能/(kJ·mol-1) | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x,该规律性是( )
A.成键时电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知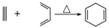 ,如果要合成
,如果要合成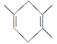 ,所用的起始原料可以是( )
,所用的起始原料可以是( )
A.2甲基?1,3丁二烯和1丁炔
B.1,3戊二烯和2丁炔
C.2,3二甲基?1,3戊二烯和乙炔
D.2,3二甲基?1,3丁二烯和丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是( )
A.2∶3 B.3∶2 C.4∶3 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3和NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
Ⅰ.提供的装置


Ⅱ.NH3的制取
(1)下列有关实验室制备气体的说法正确的是________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:_______________________
(填字母)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是______________________________。
Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:

(4)A中反应的离子方程式为________________________。
(5)装置D的作用有:使气体混合均匀、调节气流速度,还有一个作用是________________________________________________________________________。
(6)D装置中的液体可换成________(填字母)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(7)该同学所设计的模拟尾气处理实验还存在的明显缺陷是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某些化学键的键能如下表(单位kJ·mol-1),据此,回答下列问题:
| 键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 356 |
(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为____kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在Cl2中放热______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.键角决定了分子的结构
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CH4、CCl4中键长相等,键角不同
D. 中的键能是C—C中的键能的两倍
中的键能是C—C中的键能的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
某样品是由碳酸钠与氯化钠组成的固体混合物,现欲测定样品中碳酸钠的质量分数。
某同学称取10.00 g样品,配成1 000 mL溶液,用______(填仪器名称)量取25.00 mL放入锥形瓶中,加入甲基橙作指示剂,用0.150 0 mol·L-1标准盐酸溶液滴定至终点,平行测定三次,有关实验数据记录如下表,则样品中碳酸钠的质量分数为__________。
| 实验编号 | 待测液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 终点时读数 | ||
| 1 | 25.00 | 0.00 | 30.02 |
| 2 | 25.00 | 0.20 | 33.80 |
| 3 | 25.00 | 1.40 | 31.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )

A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,X是纯铜
D.制取金属镁时,Z是熔融的氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
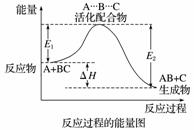
A.反应过程可表示为A+BC—→A…B…C—→AB+C
(反应物) (过渡态) (生成物)
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com