
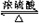 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +CaCl2+H2O
+CaCl2+H2O
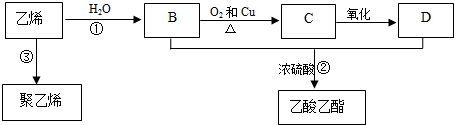
分析 乙烯和水发生加成反应生成B,B为CH3CH2OH,B被催化氧化生成C,C为CH3CHO,C被氧化生成D,D为CH3COOH,B、D发生酯化反应生成乙酸乙酯,乙烯发生加聚反应生成聚乙烯,再结合题目分析解答.
解答 解:乙烯和水发生加成反应生成B,B为CH3CH2OH,B被催化氧化生成C,C为CH3CHO,C被氧化生成D,D为CH3COOH,B、D发生酯化反应生成乙酸乙酯,乙烯发生加聚反应生成聚乙烯,
(1)乙酸乙酯分子式为C4H8O2,乙烯结构简式为CH2=CH2,故答案为:C4H8O2;CH2=CH2;
(2)反应①为乙烯和水的加成反应,D为CH3COOH,含有的官能团为羧基,
故答案为:加成反应; 羧基;
(3)反应①为乙烯和水加成反应生成乙醇,反应的方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应②为乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的方程式为C2H5OH+CH3COOH 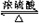 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;C2H5OH+CH3COOH  CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(4)根据绿色化学的原则,理想的生产工艺是原子利用率为100%,无污染,所以在实际生产中,应采用工艺二更环保、更经济,
故答案为:工艺二;
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯之间的转化,明确官能团及其性质关系即可解答,注意反应条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将某气体点燃,产生淡蓝色火焰,该气体一定是H2S | |
| B. | 将某气体通入紫色石蕊中,溶液变红,该气体一定是CO2 | |
| C. | 向某溶液中加入硝酸酸化的氯化钡溶液,生成白色沉淀,溶液中一定含有SO42- | |
| D. | 向某溶液中加入适量浓氢氧化钠溶液共热,产生气体能使湿润红色石蕊试纸变蓝,溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
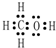 ,Y的中心原子杂化方式为SP2.
,Y的中心原子杂化方式为SP2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何一个氧化还原反应都可以设计为原电池,输出电能 | |
| B. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率越大 | |
| D. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ① | C. | ④ | D. | 均可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
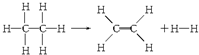
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B也可在O2作用下直接转化为D | |
| B. | 当X是强酸时,A可能是Na2S,F是H2SO4 | |
| C. | 当X是强碱时,过量的B与Cl2发生的反应为:3Cl2+2NH3═N2+6HCl | |
| D. | 无论X是强酸还是强碱,在一定条件下,B和D都能相互反应生成C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com