
【题目】以下为从铝土矿(Al2O3、Fe2O3、泥沙)提取铝的流程图(注:整个流程中,不考虑泥沙的溶解及有关反应;C可以用来治疗胃酸过多):
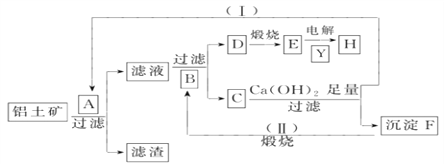
(1)A溶质的化学式___________;B的结构式____________,Y的名称_____________。
(2)写出①C与Ca(OH)2稀溶液反应的离子方程式: __________________________________。
②F→B的反应方程式: ______________________________。
(3)操作(Ⅰ)、(Ⅱ)在工业生产中的意义________________________。
【答案】 NaOH O=C=O 冰晶石 HCO3—+Ca++OH-===CaCO3↓+H2O CaCO3![]() CaO+CO2↑ (Ⅰ)、(Ⅱ)为工业原料的循环利用,使资源充分利用,可减少污染
CaO+CO2↑ (Ⅰ)、(Ⅱ)为工业原料的循环利用,使资源充分利用,可减少污染
【解析】C可以用来治疗胃酸过多,则C是碳酸氢钠,与足量氢氧化钙反应生成沉淀F为碳酸钙,A为氢氧化钠,铝土矿与氢氧化钠溶液反应时氧化铝溶解,生成偏铝酸钠和水,滤渣是氧化铁;碳酸钙高温分解生成B是CO2,通入滤液中与偏铝酸钠反应生成D为氢氧化铝沉淀和碳酸氢钠,氢氧化铝煅烧分解生成E是氧化铝,在冰晶石的作用下电解熔融的氧化铝生成铝,即H是Al,Y是冰晶石。
(1)根据以上分析可知A溶质的化学式为NaOH;B的结构式为O=C=O,Y的名称为冰晶石。(2)C与Ca(OH)2稀溶液反应的离子方程式为HCO3-+Ca++OH-=CaCO3↓+H2O。F→B的反应方程式为CaCO3![]() CaO+CO2↑。(3)根据转化关系图可知操作(Ⅰ)、(Ⅱ)在工业生产中的意义是为工业原料的循环利用,使资源充分利用,可减少污染。
CaO+CO2↑。(3)根据转化关系图可知操作(Ⅰ)、(Ⅱ)在工业生产中的意义是为工业原料的循环利用,使资源充分利用,可减少污染。
电解:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。例如本题中物质C是解答的突破口。


科目:高中化学 来源: 题型:
【题目】下列操作或叙述正确的是( )
A.配制1mol?L﹣1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
B.用小刀切下一小块金属钠,将剩余的钠再放回原试剂瓶
C.向某溶液中加入BaCl2溶液产生白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有 ![]()
D.向沸水中逐滴滴加1mol?L﹣1FeCl3溶液,并不断用玻璃棒搅拌,可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为_______反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____℃。该温度下,若向该容器中充入n(CO2)=1mol, n(H2)=1mol,4min末达到平衡,CO2的转化率为_______;H2的体积分数为________________。
(4)写出增大逆反应速率的措施:___________________;(至少写两种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D.![]() =10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
(1)Ⅰ.把氯气缓慢通入紫色石蕊溶液中,可以观察到的现象是: . 请你解释其中的原因 .
(2)Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.①其反应原理为:(用化学方程式表示) .
②实验室配制好4.0molL﹣1的NaOH溶液,这种溶液mL才能与2.24L氯气(标准状况)恰好完全反应.
③配制250mL 4.0molL﹣1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量
b.称量氢氧化钠固体
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量蒸馏水溶解称量好的氢氧化钠固体,静置冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1cm~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
①用天平称量的所需氢氧化钠固体的质量是g.
②上述步骤的正确操作顺序是 .
③上述实验需要的玻璃仪器有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. n(OH-)
C. c(NH3·H2O)/c(OH-) D. c(H﹢)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com