
吊白快化学式:NaHSO2·CH2O·2H2O ,白色块状或结晶性粉粒,溶于水,为一种化工原料。在水中吊白块能水解生成甲醛和次硫酸氢钠(NaHSO2 结构 Na+[O-S-O-H ]-)。不法分子常利用其泡制腐竹、水发食品等。添加了吊白块的食品除甲醛毒性外,残存的NaHSO2在烹调中会产生剧毒二氧化硫,导致呼吸道过敏,严重伤害人体健康。
(1)工业上生产吊白快的反应原理可用以下两个方程式表示:
_Zn+_NaHSO3→_Na2S2O4+_Na2Zn(SO3)2+_H2O
Zn+ZnS2O4+2Na2CO3+2CH2O+6H2O→2(NaHSO2·CH2O·2H2O)+2ZnCO3↓+2NaOH
配平第一个方程式并指出硫元素在两个反应中化合价变化。
(2)次硫酸氢钠可与氢氧化钾溶液反应,试写出反应的离子方程式:__________________
(3)吊白块能保鲜防腐是利用了_________,能漂白有色物质是利用了_________。
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
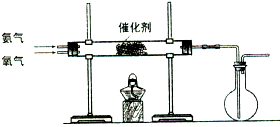 某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
某课外小组在实验室制备氨气,并进行有关氨气的性质探究.查看答案和解析>>
科目:高中化学 来源: 题型:
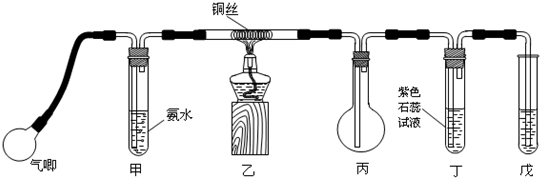
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。
①应该选用的仪器及装置有(填字母) 。
②生石灰与氯化铵反应生成氨气的化学方程式为 。
(2)该小组同学设计如图16所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。再选择合适的方案并说明原因。
②检验产物中有NH4+的方法为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com