
| A.13 | B.7 | C.5.2 | D.1 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
A.HCO3-+H2O  H3O++CO32- H3O++CO32- |
B.HCO3-+H2O  OH-+H2CO3 OH-+H2CO3 |
C.NH3+H2O  NH4++OH- NH4++OH- |
| D.HCO3-+OH- =CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.将溶液稀释,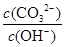 减少 减少 |
| B.滴人含0.l mol CH3COOH的溶液:c ( CH3 COO一)<c( HCO3一) |
| C.通人0.1 mo1CO2气体,溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3) |
| D.滴人酚酞,微热,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者大于后者 |
D.分别加入NaOH固体,恢复到原温度,c(C )均增大 )均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++B2-。回答下列问题。
H++B2-。回答下列问题。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴加甲基橙溶液呈黄色 | B.c(HCO3-)>c(H2CO3)>c(CO32-) |
| C.c(OH-)=c(H+)+c( H2CO3)-c (CO32-) | D.加水稀释,c( H2CO3)/c(HCO3-)的比值减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-,通入CO2,平衡朝正反应方向移动 HCO3-+OH-,通入CO2,平衡朝正反应方向移动 |
| B.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡 |
| C.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力降低 |
| D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CH3COOH + H2O  CH3COO- + H3O+ CH3COO- + H3O+ |
B.Br- + H2O  HBr + OH- HBr + OH- |
C.CO32- + 2H2O H2CO3 + 2OH- H2CO3 + 2OH- |
D.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com