
| A. | 该条件下Z是气态 | B. | 平衡常数K=$\frac{c(Z)•c(W)}{c(X)•c(Y)}$ | ||
| C. | 增加Z平衡逆向移动 | D. | 上述过程中X的转化率变大 |
分析 达到平衡后容积为V,压缩容积至0.5V,并保持容积不变,如平衡不发生移动,则X的浓度为原平衡状态的2倍,而此时X的浓度为原平衡状态的1.8倍,说明平衡正向移动,则Z为固体或液体,以此解答该题.
解答 定温度时,在容积可变的密闭容器中发生反应:X(g)+Y(g)?Z(?)+W(g),达到平衡后容积为V,压缩容积至0.5V,并保持容积不变,如平衡不发生移动,则X的浓度为原平衡状态的2倍,而此时X的浓度为原平衡状态的1.8倍,说明平衡正向移动,则Z为固体或液体,平衡常数K=$\frac{c(W)}{c(X)c(Y)}$,只有D正确.
故选D.
点评 本题考查化学平衡移动的影响,为高频考点,侧重考查学生的分析能力,题目难度不大,本题注意用假定法判断,如果平衡不移动,则达到平衡时X的浓度为原来的2倍,根据实际X的浓度,判断平衡移动.


科目:高中化学 来源: 题型:解答题
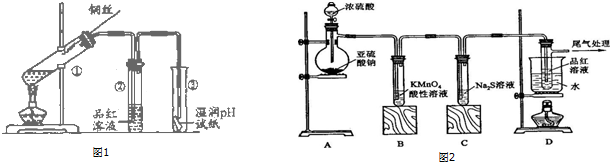
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质R的转化率减少了 | ||
| C. | 物质X的质量分数减少了 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
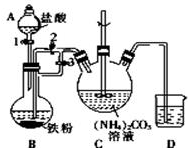 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
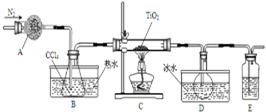 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单体的质量之和就是所生成高聚物的质量 | |
| B. | 氨基酸能发生的反应有:酯化反应、水解反应、成肽反应、与酸或碱的中和反应 | |
| C. | 天然蛋白质的水解产物为α-氨基酸,遇饱和硫酸铵或硫酸钠溶液会发生变性 | |
| D. | 淀粉和纤维素因聚合度不同所以他们不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应会放出热量 | |
| B. | 每生成1mol N2,转化电子数为4mol | |
| C. | 等物质的量N2和CO质量相同 | |
| D. | 该反应不需要催化剂常温下也能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com