
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。

①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:

NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。

【答案】 4NH3+5O2 ![]() 4NO+6H2O 0.01 200 2NO(g)+O2(g)
4NO+6H2O 0.01 200 2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]() kJ/mol 适当降低温度,增大氧气浓度 NO-3e-+2H2O=NO
kJ/mol 适当降低温度,增大氧气浓度 NO-3e-+2H2O=NO![]() +4H+ 2kg
+4H+ 2kg
【解析】(1)氨与氧气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O;(2)①由图象可知O2浓度的变化计算v(O2)=
4NO+6H2O;(2)①由图象可知O2浓度的变化计算v(O2)=![]() ,v(NO)=2 v(O2)=
,v(NO)=2 v(O2)=![]() ;
;
② 2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
起始浓度 0.01 0.005 0
平衡浓度 0.005 0.0025 0.005
则k=![]() ;③i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630KJ/mol=+183kJ/mol,
;③i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630KJ/mol=+183kJ/mol,
ii.N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol
则盖斯定律ii-i得到2NO(g)+O2(g)=2NO2(g)△H=-115 kJ/mol,为了提高NO的转化率必须使平衡正向移动,反应为放热反应,可适应降低温度,或增大增大氧气浓度;(3)电解过程中NO转化为硝酸的电极反应式为:NO-3e-+2H2O=![]() +4H+,根据反应可知,若处理标准状况下448L的NO为20mol,则可得到质量分数为63%的HNO3溶液的质量是
+4H+,根据反应可知,若处理标准状况下448L的NO为20mol,则可得到质量分数为63%的HNO3溶液的质量是![]() 。
。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。常温下,B、E呈气态,其中B呈黄绿色。D是最常见的无色液体,E常用作制冷剂,F是一种不溶于水的碱,G是厨房中的常见调味品,H由两种元素组成,其摩尔质量为32 g·mol-1。

(1) E的电子式为____。
(2) H的化学式为____。
(3) 写出反应①的离子方程式:_________________。
(4) 写出反应②的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
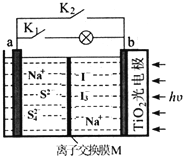
A. 充电时,太阳能转化为电能,又转化为化学能
B. 放电时,a极的电极反应式为:4S2--6e-=S42-
C. 充电时,阳极的电极反应式为:3I--2e-=I3-
D. M是阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质为含Si、Fe(III)、Cu、Cd等元素的化合物)为原料,制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
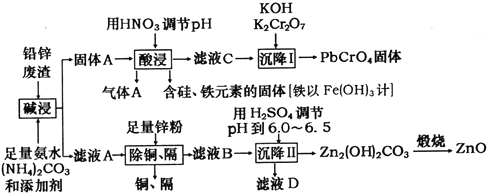
已知常温下Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=7.4×10-14,Ksp[Fe(OH)3]=1.0×10-38。
(1)“碱浸”过程中PbSO4发生反应的离子方程式为_______________________________,气体A的化学式为_________________________。
(2)“酸浸”过程中,在常温下应控制pH不低于________________________________。
(3)“沉降I”中发生沉降反应的离子方程式为____________________________。
(4)滤液D中溶质的主要成分为________________。
(5)以1t含锌元素10%的铅锌废渣制得活性氧化锌113.4kg,依据以上数据能否计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由。___________________。
(6)常温下NH3·H2O的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=5.6×10-11。该温度下某浓度的(NH4)2CO3溶液中c(NH4+)/c(NH3·H2O)=18。则溶液pH为__________________,c(HCO3-)/c(H2CO3)=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
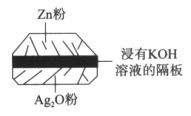
(1)该电池属于__________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是____________。
(3)使用时,负极区的pH_______(填“增大”、“减小”或“不变”,下同),电解质溶液的pH__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是

A.溶液酸性越强,R 的降解速率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )

A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空:
(1)水的电离与溶液的酸碱性密切相关。
①常温下,某柠檬水溶液的pH=3,其中的c(OH-)=__________。
②常温下,浓度均为0.1 molL-1的CH3COOH溶液和CH3COONa溶液中,水的电离程度大小关系是:前者_____________后者(填“>”“<”或“=”);
③常温下,浓度均为0.1 molL-1的NaX和NaY两种盐溶液,其pH分别为8 和10,则HX 和HY的酸性强弱关系是:HX_________HY(填“>”或“<”)。
(2)研究化学能与电能相互转化的装置、过程和效率的科学,叫做电化学。
①某原电池装置如右图,则:
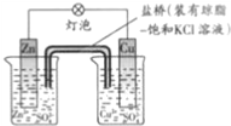
该原电池的负极是__________(填“Zn”或“Cu”),正极的电极反应式为_______________________;
②用铂电极电解某金属氯化物(XCl2)的溶液,当收集到2.24 LCl2(标准状况)时,阴极增重6.4 g,则该金属的相对原子质量为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
H-H | N-H | N-N | N≡N |
435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com