
| A. | Q1=$\frac{1}{2}$Q | B. | Q1<$\frac{1}{2}$Q | C. | Q1>$\frac{1}{2}$Q | D. | Q1=Q |
分析 根据可逆反应的特点可知,可逆反应是不能进行到底的反应,即反应后的体系中含有所有反应物和生成物,据此判断Q2和Q的关系.
解答 解:若将 1mol SO2和0.5mol O2在相同条件下放入密闭容器发生反应,因2SO2+O2?2SO3是可逆反应,则 1mol SO2和0.5mol O2不会完全反应生成1molSO3,即生成SO3的量小于1mol,而生成2mol SO3 放出的热量为Q,生成1mol SO3 放出的热量为0.5Q,
所以生成小于1mol的SO3时放出的热量必小于0.5Q,即 Q1<$\frac{1}{2}$Q,
故选B.
点评 本题考查了可反应热的计算、可逆反应特点,明确可逆反应特点为解答关键,注意掌握反应热的计算方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
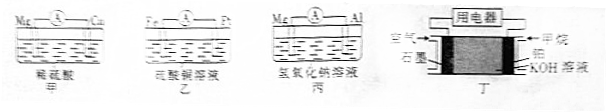
| 装置序号 | 负极 | 阳离子移向 (填电极材料名称) |
| 甲 | ||
| 乙 | . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
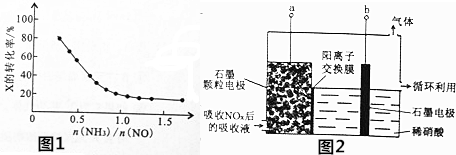
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液可盛放在碱式滴定管中 | |
| B. | 可用酚酞或甲基橙作滴定的指示剂 | |
| C. | 若滴定管未用待测KMnO4溶液润洗,则会使测得的KMnO4溶液浓度偏小 | |
| D. | 滴定过程中褪色速率先慢后快,是由于锥形瓶中KMnO4溶液浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
根据以下3个热化学方程式
2H2S(g)+3O2(g)==2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)==2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S (g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
(g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com