
| A. | 原子半径Z>X>Y | |
| B. | 最高价氧化物的水化物酸性强弱W>Z>Y | |
| C. | 简单气态氢化物的稳定性Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
分析 X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子M层有1个电子,则X为Na元素;
Y原子最外层电子数为最内层电子数的2倍,其最外层电子数是4,为Si元素;
Z元素的最高化合价为最低化合价绝对值的3倍,则Z为S元素;
W为短周期主族元素且原子序数大于Z,所以为Cl元素;
A.同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.W为Cl元素、X为Na元素、Y为Si元素,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键.
解答 解:X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子M层有1个电子,则X为Na元素;
Y原子最外层电子数为最内层电子数的2倍,其最外层电子数是4,为Si元素;
Z元素的最高化合价为最低化合价绝对值的3倍,则Z为S元素;
W为短周期主族元素且原子序数大于Z,所以为Cl元素;
A.同一周期元素,原子半径随着原子序数增大而减小,所以原子半径X>Y>Z>W,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性W>Z>Y,所以其最高价氧化物的水化物酸性W>Z>Y,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性W>Z,所以氢化物的稳定性W>Z,故C错误;
D.W为Cl元素、X为Na元素、Y为Si元素,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,所以氯化钠中只含离子键、四氯化硅只含共价键,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,涉及元素推断、元素周期律、化学键等知识点,侧重考查学生分析判断及知识运用能力,注意元素周期律中反常现象,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
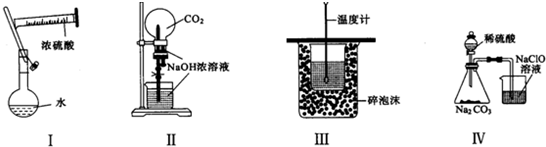
| A. | 实验Ⅰ:配制一定物质的量浓度的稀硫酸 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:验证酸性的强弱,H2SO4>H2CO3>HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
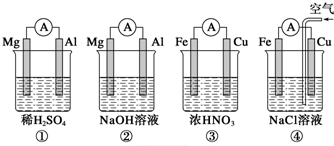
| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,OH-向Al电极移动 | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Na++2e-=2Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,在浓硫酸的作用下乙醇和乙酸有一种能消耗完 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 元素W最高价氧化物的水化物为强酸 | |
| D. | 化合物从X2Y、Z2Y中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| C. | 元素X与氢形成的化合物可能既有极性键又有非极性键 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-a=m+n | B. | a+b=m+n | C. | a-b=m-n | D. | a-b=m+n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com