


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、CaCl2易吸收空气中的水分 |
| B、Ca(ClO)2易与盐酸反应 |
| C、Ca(ClO)2见光易分解 |
| D、Ca(ClO)2易与空气中的CO2和水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电离时生成的阳离子全部是氢离子的化合物一定是酸 |
| B、所有的盐电离时只能生成酸根阴离子和金属阳离子 |
| C、氧化物是指含有氧元素的化合物,如NaOH、H2SO4等 |
| D、氨气溶于水溶液显碱性,所以氨气属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- |
| B、加盐酸生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| C、用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ |
| D、加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 试样 | NaCl溶液(Na2CO3) | NaCl固体(I2) | CO2(SO2) | NaHCO3溶液(Na2CO3) |
| 除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
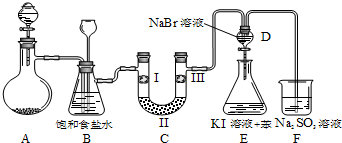
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com