
【题目】用 AG 表示溶液酸度:AG=lg![]() 。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
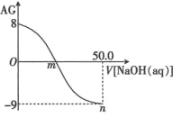
A.常温下 CH3COOH 的 Ka 数量级为 10-6
B.m 点加入 NaOH 的体积为 25 mL
C.n 点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在滴加 NaOH 溶液的过程中,溶液中 m 点水的电离程度最大
【答案】C
【解析】
0.1 mol·L-1 的 CH3COOH的溶液酸度AG=lg![]() =8,又
=8,又![]() ,故
,故![]() ,
,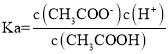 ,酸碱均会抑制水的电离,盐能促进水的电离。
,酸碱均会抑制水的电离,盐能促进水的电离。
A.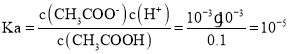 ,数量级为10-5,故A错误;
,数量级为10-5,故A错误;
B.m 点AG=lg![]() =0,故
=0,故![]() ,醋酸与氢氧化钠恰好中和显碱性,不符合
,醋酸与氢氧化钠恰好中和显碱性,不符合![]() ,故B错误;
,故B错误;
C.n 点溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),又在n 点AG=lg![]() =-9,故溶液显碱性c(H+)<c(OH-),c(Na+)>c(CH3COO-),故c(Na+)>c(OH-)>c(CH3COO-)>c(H+),C正确;
=-9,故溶液显碱性c(H+)<c(OH-),c(Na+)>c(CH3COO-),故c(Na+)>c(OH-)>c(CH3COO-)>c(H+),C正确;
D.在滴加 NaOH 溶液的过程中,酸碱恰好反应完全时,溶质只有可水解的盐,水的电离程度最大,m点未达到中和点,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知某些元素在周期表中的位置如图所示:
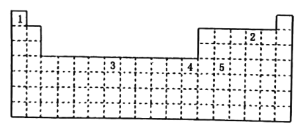
下列说法正确的是( )
A.表中五种元素位于5个不同的区
B.元素4的基态原子的价电子排布式为3d104s2与它具有相同最外层电子数的元素只可能处于ds区
C.元素1、2、3的基态原子中,未成对电子数之比为1:3:5
D.元素5的原子结构示意图为: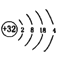
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法转化CO2可实现CO2资源化利用。电解CO2制甲酸盐的装置如图所示。下列说法中错误的是( )
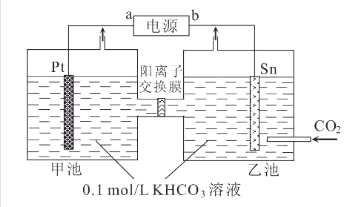
A.b是电源负极
B.K+由乙池向甲池迁移
C.乙池电极反应式为:CO2+HCO3-+2e-=HCOO-+CO32-
D.两池中KHCO3溶液浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲酸是原子利用率高的反应,且生成的甲酸是重要化工原料。下列说法不正确的是( )
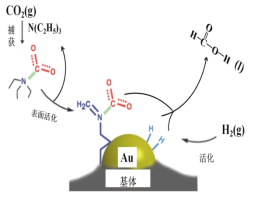
A. 二氧化碳的电子式: ![]()
B. 在捕获过程,二氧化碳分子中的共价键完全断裂
C. N(C2H5)3能够协助二氧化碳到达催化剂表面
D. CO2催化加氢合成甲酸的总反应式:H2+CO2=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5 mol·L-1 MgCO3的饱和溶液中c(Mg2+)为2.6×10-3 mol·L-1。若在5 mL浓度均为0.01 mol·L-1的CaCl2和MgCl2溶液中,逐滴加入5 mL 0.012 mol·L-1 Na2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A.25℃时,Ksp(CaCO3)=2.8×10-9
B.加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C.滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-)
D.滤液M中:![]() =
=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
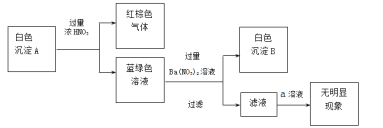
请回答:
Ⅰ.根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ.仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
Ⅲ.向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整: Cu2++ SCN-= CuSCN↓+ (SCN)2__
③结合上述过程以及Fe(SCN)3Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)和钛白粉(TiO2)均为重要的墙面装修颜料。一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示:
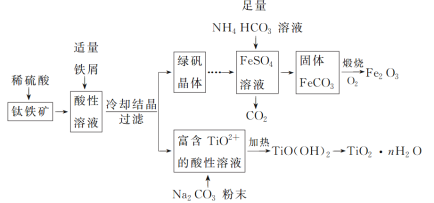
回答下列问题:
(1)FeTiO3中Fe的化合价为_______。
(2)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有_______ (任写两种)。酸性溶液中加入适量铁屑的目的是将_______。
(3)FeSO4溶液与NH4HCO3溶液的反应温度应控制在35 ℃以下,其原因是_______,该反应的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。
(4)TiO2+转化为TiO(OH)2需要加热,加热的目的是_______,该反应的离子方程式为TiO2++2H2O![]() TiO(OH)2↓+2H+。
TiO(OH)2↓+2H+。
(5)常温时,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-)=3.0×10-6 mol·L-1,pH为8.5,则所得的FeCO3中是否含Fe(OH)2_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用水吸收SO2气体时,溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中![]() =________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
=________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hagemann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
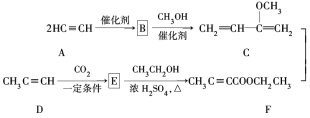
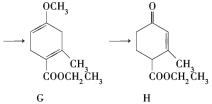
(1)A→B为加成反应,则B的结构简式是________;B→C的反应类型是_______。
(2)H中含有的官能团名称是__________;F的名称(系统命名)是_______。
(3)E→F的化学方程式是______________。
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O-)。TMOB的结构简式是________。
(5)下列说法正确的是_______。
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F用溴水可以鉴别
c.1 mol G完全燃烧生成7 mol H2O
d.H能发生加成、取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com