
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | 将钠投入滴有紫色石蕊试液的水中,水溶液变为红色 | |
| C. | 将一小块钠放在CuSO4溶液中发生反应离子方程式:2Na+Cu2+═2Na++Cu | |
| D. | 将4.6gNa投入到95.4g水中,所得溶液中溶质的质量分数大于8.0% |
分析 A、钠在空气中燃烧生成过氧化钠;
B、钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性;
C、金属钠放入CuSO4溶液中,钠会先和H2O反应,生成的NaOH再与CuSO4反应;
D、钠投入到水中,发生根据反应的化学方程式分析生成NaOH的质量和溶液的质量,进而计算溶质的质量分数.
解答 解:A、钠在空气中燃烧生成过氧化钠,而不是氧化钠,故A错误;
B、钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色,不是红色,故B错误;
C、金属钠放入CuSO4溶液中,钠会先和H2O反应,生成的NaOH再与CuSO4反应,生成氢氧化铜,而不是单质铜,故C错误;
D、由于钠是活泼金属能与水发生2Na+2H2O=2NaOH+H2↑的反应,所以反应后生成的溶质设2.3克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y:
2Na+2H2O═2NaOH+H2↑
46 80 2
4.6g x y
则:$\frac{46}{4.6}=\frac{80}{x}=\frac{2}{y}$
解得x=8g;y=0.2g,
反应后所得溶液的质量分数:$\frac{8g}{4.6g+95.4g-0.2g}$×100%=8.02%,该值一定大于8%,故D正确;
故选D.
点评 本题考查钠的性质,其中选D通过回答本题知道了有的物质放入水中溶质会发生改变,此时的溶质的质量要根据方程式算出再进行计算.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳与稀盐酸反应:H++OH-═H2O | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3的质量为17 g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 3.01×1023个O3分子和 3.01×1023个O2分子电子数之比等于1:1 | |
| D. | 等物质的量的CO2分子和CO分子的质量比等于11:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
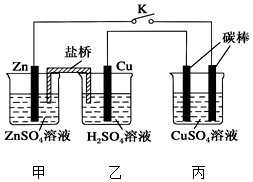 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
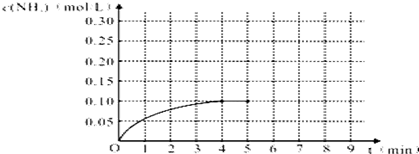
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
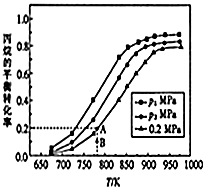 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com