
碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为
A.3.38g B. 4.58g C. 4.16g D. 4.41g
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是 ( )
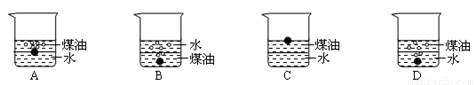
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第四次摸底考试化学试卷(解析版) 题型:选择题
以0.10 mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示。下列表述正确的是

A.此实验可以选用甲基橙作指示剂
B.该酸HA的浓度约为1×10-4 mol/L
C.当NaOH体积为9 mL时,恰好完全中和反应
D.达到滴定终点时,溶液中c(Na+)>c (A-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省邵阳市高一上学期第三次月考化学试卷(解析版) 题型:推断题
已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:

(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期12月月考化学试卷(解析版) 题型:选择题
判断给定化学反应是否为氧化还原反应的依据是
A.看反应前后是否有氧原子的得失
B.看反应前后是否有原子的重新组合
C.看反应前后是否有元素的化合价发生改变
D.看反应后是否有气体生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期期末考试化学试卷(解析版) 题型:填空题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.步骤②中滤液氧化的目的是 。
c.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市高一上12月阶段测化学试卷(解析版) 题型:选择题
饱和氯水久置后,溶液中的各种粒子:①Cl2 ②ClO- ③Cl- ④HClO ⑤ H+ 减少的是
A.①②④ B.①②③ C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期12月月考化学试卷(解析版) 题型:填空题
0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为 。若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于 烃,结构简式为 ,名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com