
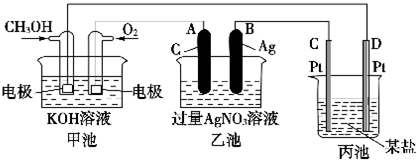
分析 燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH--6e-═CO32-+6H2O,通入氧化剂的电极为正极,正极反应为O2+4e-+2H2O=4OH-,A是阳极、B是阴极,阳极、阴极电极反应分别为4OH--4e-=O2↑+2H2O、Ag++e-=Ag,C是阳极,D是阴极,据此结合电子守恒进行分析解答.
解答 解:燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH--6e-═CO32-+6H2O,通入氧化剂的电极为正极,正极反应为O2+4e-+2H2O=4OH-,A是阳极、B是阴极,阳极、阴极电极反应分别为4OH--4e-=O2↑+2H2O、Ag++e-=Ag,C是阳极,D是阴极,
(1)通入O2的电极是正极,C(Pt)电极的名称是阳极,故答案为:正极;阳极;
(2)通入O2的电极上的电极反应式是O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(3)燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH--6e-═CO32-+6H2O,故答案为:CH3OH+8OH--6e-═CO32-+6H2O
(4)A是阳极、B是阴极,阳极、阴极电极反应分别为4OH--4e-=O2↑+2H2O、Ag++e-=Ag,反应的化学方程式为2H2O+4AgNO3$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:2H2O+4AgNO3$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(5)当乙池中B(Ag)极的质量增加5.40g时,根据Ag++e-=Ag,转移电子是$\frac{5.40g}{108g/mol}$=0.05mol,根据O2+4e-+2H2O=4OH-,甲池中理论上消耗O2的体积是:$\frac{0.05mol}{4}$×22.4L/mol=0.28L=280mL,故答案为:280.
点评 本题考查了原电池和电解池原理,根据得失电子确定正负极,再结合离子放电顺序确定阴阳极上发生的反应,难点是电极反应式的书写.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 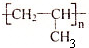 | B. |  | C. | 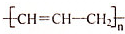 | D. | 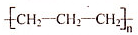 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫代硫酸钠与稀硫酸反应的离子方程式为S2O32-+2H+═SO42-+S↓+H2O | |
| C. | 利用水解原理制备纳米材料TiCl4+(2+n)H2O?4HCl+TiO2?nH2O↓ | |
| D. | 向明矾溶液中滴加Ba(OH)2至SO42-恰好完全沉淀时Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3CO0-) | |
| B. | 加水稀释时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈酸性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | |
| B. | 将NaOH溶液和氨水各稀释一份,两者的OH-浓度均减小到原来的$\frac{1}{2}$ | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| D. | 若电解质溶液的导电能力也可能比强电解质溶液的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:3s23p1Y:3s23p5 | B. | X:3s2 Y:2s22p3 | ||
| C. | X:3s23p2 Y:2s22p4 | D. | X:3d64s2Y:2s22p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com