
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
【答案】B
【解析】分析:A项,1个CH4分子中含5个原子;B项,1个OH-中含9个质子;C项,D2的摩尔质量为4g/mol,1个D2中含2个中子;D项,标准状况下气体摩尔体积为22.4L/mol,1个NH3分子中含10个电子。
详解:A项,n(CH4)=![]() =1mol,1个CH4分子中含5个原子,16gCH4含有原子数为5NA,A项错误;B项,n(OH-)=
=1mol,1个CH4分子中含5个原子,16gCH4含有原子数为5NA,A项错误;B项,n(OH-)=![]() =1mol,1个OH-中含9个质子,17gOH-含有的质子数为9NA,B项正确;C项,D2的摩尔质量为4g/mol,n(D2)=
=1mol,1个OH-中含9个质子,17gOH-含有的质子数为9NA,B项正确;C项,D2的摩尔质量为4g/mol,n(D2)=![]() =0.5mol,1个D2中含2个中子,2gD2含有的中子数为NA,C项错误;D项,n(NH3)=
=0.5mol,1个D2中含2个中子,2gD2含有的中子数为NA,C项错误;D项,n(NH3)=![]() =1mol,1个NH3分子中含10个电子,标准状况下22.4LNH3含有的电子数为10NA,D项错误;答案选B。
=1mol,1个NH3分子中含10个电子,标准状况下22.4LNH3含有的电子数为10NA,D项错误;答案选B。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列框图中的物质均为中学化学常见物质。已知A、B、C均为有刺激性气味的气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体。反应①需要有水参加,反应②有大量白烟生成。
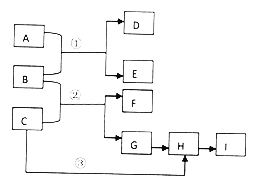
请回答下列问题:
(1)写出下列反应的化学方程式:
反应①_____________________________________;
反应②_______________________________________;
反应③____________________________________________;
(2)用Na2CO3溶液吸收I生成CO2,若9.2gI和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应:2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
下列说法正确的是
A. 其他条件不变,容器乙达到平衡后,再充入体系中四种气体各1mol,平衡逆向移动
B. b=1.6
C. 平衡常数:K甲>K乙
D. 其他条件不变,向容器甲再充入1mol CO,平衡常数(K)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置就用于实验室制取NH3 , 并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
A.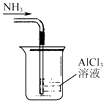
吸收NH3制取Al(OH)3
B.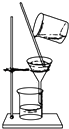
在不断搅拌下分离Al(OH)3和NH4Cl溶液
C.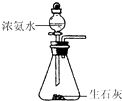
制取NH3
D.
蒸干NH4Cl溶液并灼烧制NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在2 L固定体积的密闭容器中,发生可逆反应:2NO2(g) ![]() N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
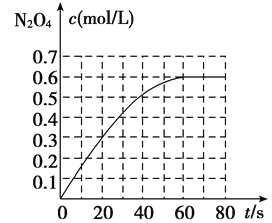
A. v(正)>v(逆)
B. v(正)<v(逆)
C. v(正)=v(逆)
D. v(正)、v(逆)大小关系不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的密度依次增大
B.单质的熔、沸点依次升高
C.Cl2可以从KI溶液中置换出I2
D.Br2可以从NaCl溶液中置换出Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某密闭容器中,可逆反应:N2 (g) +3H2(g) ![]() 2NH3 (g)达到化学反应限度的标志是
2NH3 (g)达到化学反应限度的标志是
A. 正、逆反应速率都等于零 B. N2、H2、NH3在容器中共存
C. N2、H2、NH3的浓度不再变化 D. N2、H2、NH3的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离子键,又含有共价键的物质是_______,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程: __________。
(3)氮化钠(Na3N)是科学家制备的种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com