
NH3经一系列反应可以得到HNO3,如下图所示。
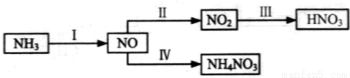
(1)I中,NH3 和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
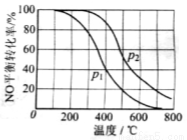
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
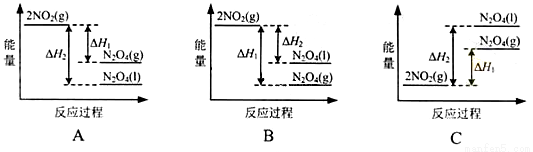
(3)III中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)△H1
N2O4(g)△H1
2NO2(g) N2O4(l)△H2
N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)_______________。
②N2O4与O2、H2O化合的化学方程式是_________________。
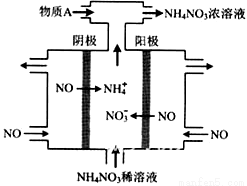
(4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。
(1)4NH3+5O2  4NO+6H2O;
4NO+6H2O;
(2)①P1<P2;
②减小;
(3)①A;
②2N2O4+O2+2H2O=4HNO3;
(4)氨气;根据反应8NO+7H2O 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
【解析】
试题分析:(1)氨气和氧气在催化剂作用下发氧化还原反应,生成NO和水,化学方程为4NH3+5O2  4NO+6H2O;
4NO+6H2O;
(2)①该反应的正反应为气体物质的量减小的反应,其他条件不变时,增大压强,平衡向气体物质的量减小的方向移动,即向正反应方向移动,即压强越高,NO的平衡转化率越大,根据图示知,相同温度下,压强P1时NO的转化率<P2时NO的转化率,故P1<P2;
②其他条件不变时,升高温度,平衡向着吸热反应方向移动,又根据图示知,相同压强下,随着温度的升高,NO的转化率降低,即升高温度,平衡向逆反应方向移动,故逆反应方向为吸热反应,则正反应方向是放热反应,则随着温度的升高,该反应的平衡常数减小;
(3)①
2NO2(g) N2O4(g)△H1 ①
N2O4(g)△H1 ①
2NO2(g) N2O4(l)△H2 ②
N2O4(l)△H2 ②
根据盖斯定律:①-②得
N2O4(g) N2O4(l) △H3=△H1-△H2,一般来说,物质由气态变为液态,放出热量,即△H3=△H1-△H2<0,即△H1>△H2,由降低温度,将NO2转化为N2O4,可知该反应为放热反应,即0>△H1>△H2,即反应物2NO2(g)的总能量大于生成物N2O4(g)和N2O4(l)的总能量,且前者放出的热量小,故答案为A;
N2O4(l) △H3=△H1-△H2,一般来说,物质由气态变为液态,放出热量,即△H3=△H1-△H2<0,即△H1>△H2,由降低温度,将NO2转化为N2O4,可知该反应为放热反应,即0>△H1>△H2,即反应物2NO2(g)的总能量大于生成物N2O4(g)和N2O4(l)的总能量,且前者放出的热量小,故答案为A;
②N2O4与氧气、水反应生成硝酸,化学方程式为:2N2O4+O2+2H2O=4HNO3;
(4)电解NO制备硝酸铵,阳极反应为:NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出若要使电子得失守恒,阳极产生的NO3-的量大于阴极产生的NH4+的量,总反应为8NO+7H2O 3NH4NO3+2HNO3,故应补充适量的氨气。
3NH4NO3+2HNO3,故应补充适量的氨气。
考点:本题考查氨的催化氧化反应、化学平衡、化学反应中的能量变化、电解知识等内容。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:填空题
〔化学—选修2:化学与技术〕(15分)
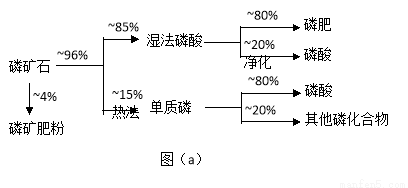
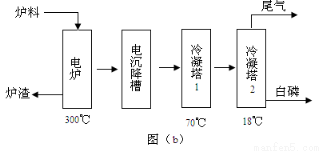
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 |
白磷 | 44 | 280.5 |
|
PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(安徽卷解析版) 题型:选择题
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是
选项 | 规律 | 结论 |
A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:推断题
(16分)A是一种有机合成中间体,其结构简式为: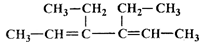 。A的合成路线如下图,其中B~H分别代表一种有机物。
。A的合成路线如下图,其中B~H分别代表一种有机物。
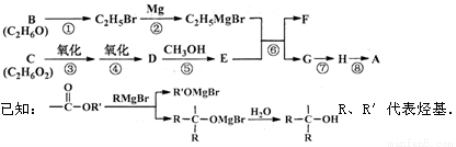
请回答下列问题:
(1)A中碳原子的杂化轨道类型有_____;A的名称(系统命名)是____;第⑧步反应类型是___。
(2)第①步反应的化学方程式是________。
(3)C物质与CH2=C(CH3)COOH按物质的量之比1:1反应,其产物经加聚得到可作隐形眼镜的镜片材料I。I的结构简式是_______________。
(4)第⑥步反应的化学方程式是________________。
(5)写出含有六元环,且一氯代物只有2种(不考虑立体异构)的A的同分异构体的结构简式____。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.Cl2通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D.Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(北京卷解析版) 题型:选择题
下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O NH4++OH-
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2  Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(全国大纲卷解析版) 题型:选择题
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且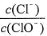 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A.若某温度下,反应后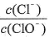 =11,则溶液中
=11,则溶液中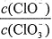 =
=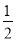
参加反应的氯气的物质的量等于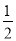 amol
amol
C.改变温度,反应中转移电子的物质的量ne的范围: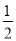 amol≤ne≤
amol≤ne≤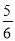 amol
amol
D.改变温度,产物中KC1O3的最大理论产量为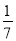 amol
amol
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.2Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:选择题
已知x、Y是元素周期表中前20号元素,二者原子序数相差3,x、Y能形成化台物M,下列说法正确的是
A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径
B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性
C.若M属于离子化合物,则该化合物中只存在离子键
D.若M属于离子化台物,则该化合物中原子个数比可能为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com