

���� ��Ϸ�Ӧ�����з�Ӧ�����֪��E����ɫ����Ϊ��������DΪFe��OH��3��CΪFe��OH��2��BΪFeCl2��AΪFe�������������ӣ����ȼ�KSCN��Һ���������ټ�����ˮ�����������������ӣ���Һ��ɺ�ɫ���Դ˽����⣬�ݴ˷����ش����⣮
��� �⣺��Ϸ�Ӧ�����з�Ӧ�����֪��E����ɫ����Ϊ��������DΪFe��OH��3��CΪFe��OH��2��BΪFeCl2��AΪFe��
��1��������֪EΪFe2O3���ʴ�Ϊ��Fe2O3��
��2��C��D�������������仯Ϊ������������Ӧ������Ϊ��ɫ����Ѹ�ٱ仯Ϊ����ɫ���仯Ϊ���ɫ��
�ʴ�Ϊ����ɫ����Ѹ�ٱ仯Ϊ����ɫ���仯Ϊ���ɫ��
��3��ʵ���Ҽ���B�������ӵķ����ǣ������������ӣ����ȼ�KSCN��Һ���������ټ�����ˮ����Һ��ɺ�ɫ����ԭ��Һ��Fe2+�����������ױ�����Ϊ�����ӣ������������Ƿ�ֹ�������ӱ�������2Fe3++Fe=3Fe2+��
�ʴ�Ϊ�����ȼ�KSCN��Һ���������ټ�����ˮ����Һ��ɺ�ɫ����ԭ��Һ��Fe2+����ֹ�������ӱ�������
��4��D��E��ת���ǽ��������������ȷֽ⣬2Fe��OH��3$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+3H2O�����෴Ӧ��������ˮ�Ľ������������ȷֽ����ɶ�Ӧ��̬�½����������ˮ��
��������ˮ�Ľ������������ȷֽ����ɶ�Ӧ��̬�½����������ˮ��
���� ���⿼���������仯�������ʡ�����ת����ϵ�����жϡ���Ӧ����������ȣ����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ӵ���Ŀ | B�� | ���ӵĴ�С | C�� | ����֮��ľ��� | D�� | ���ʵ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ | B�� | �ж�����̼���ɵķ�Ӧ | ||
| C�� | ������ | D�� | ��ˮ���ɵķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��CO32-����c��H2CO3�� | B�� | c��Na +����c��HCO3-����c��H +����c��OH -�� | ||
| C�� | c��Na+��+c��H+���Tc��HCO3-��+c��CO 32-��+c��OH-�� | D�� | c��Na+���Tc��HCO3-��+c��CO32-��+c��H2CO3 �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+��=0.1mol•L-1����Һ��Na+��NH4+��SO42-��S2O32- | |
| B�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��10-12����Һ��K+��AlO2-��CO32-��Na+ | |
| C�� | ����ˮ�������c��H+��=1��10-12mol•L-1����Һ��Fe3+��ClO-��Na+��SO42- | |
| D�� | c��Fe3+��=0.1mol•L-1����Һ��H+��Al3+��Cl-��SCN- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
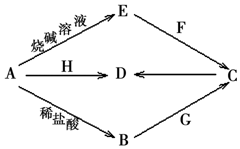 ������Ԫ�ؽ�������A�ɷ�����ͼ��ʾ����ת�������ַ�Ӧ���Ӧ�����Ͳ�������ȥ����F�ǻ�ʯȼ��ȼ�ղ�����һ���������壻�����£�G��һ���д̼�����ζ�����壬��ˮ��Һ�������ԣ�H��һ�־��д��Եĺ�ɫ�����B��C��D��E���ֻ������к���һ����ͬ��Ԫ�أ�
������Ԫ�ؽ�������A�ɷ�����ͼ��ʾ����ת�������ַ�Ӧ���Ӧ�����Ͳ�������ȥ����F�ǻ�ʯȼ��ȼ�ղ�����һ���������壻�����£�G��һ���д̼�����ζ�����壬��ˮ��Һ�������ԣ�H��һ�־��д��Եĺ�ɫ�����B��C��D��E���ֻ������к���һ����ͬ��Ԫ�أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 32��O2��������ԭ����ĿΪNA | |
| B�� | 0.5molH2O���е�ԭ����ĿΪ1.5 NA | |
| C�� | 1molH2O���е�H2O������ĿΪNA | |
| D�� | 0.5 NA����������������ԭ�ӵ����ʵ�����1mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com