
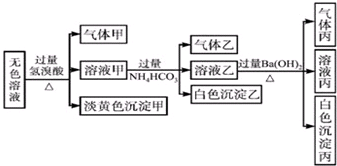
 某无色溶液中可能含有离子:Na+、Ag+、Fe3+、Ba2+、Al3+、S2-、AlO2-、SO32-、SO42-,现取该溶液进行有关实验,实验结果如图所示:由该实验可知( )
某无色溶液中可能含有离子:Na+、Ag+、Fe3+、Ba2+、Al3+、S2-、AlO2-、SO32-、SO42-,现取该溶液进行有关实验,实验结果如图所示:由该实验可知( )| A、浅黄色沉淀甲可能为AgBr |
| B、由溶液甲生成沉淀乙的离子方程式为:Al3++3HCO3-═Al(OH)3+3CO2 |
| C、气体乙是NH3 |
| D、综合上述信息可以确定肯定存在的离子有:SO32-、S2-、Al3+、Na+ |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
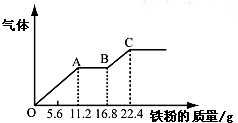 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合酸中NO3-物质的量为0.4 mol |
| B、原混合酸中H2SO4浓度为2.0 mol?L-1 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液、NaOH溶液、碱石灰 |
| B、饱和氨水 |
| C、NaOH溶液、NH4Cl溶液、浓H2SO4 |
| D、NH4Cl固体、碱石灰、消石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③ |
| C、③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、只有③ |
| C、只有① | D、只有①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精-剧毒品 |
| B、浓硫酸-腐蚀品 |
| C、汽油-腐蚀品 |
| D、烧碱-剧毒品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) |
| B、c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) |
| C、c(HS-)+c(S2-)+c(H2S)=0.1 mol?L-1 |
| D、c(S2-)+c(OH-)=c(H2S)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com