
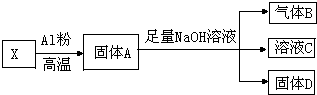
 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)分析 Fe2O3、CuO和铝在高温下发生铝热反应生成铁、铜和氧化铝,故固体A可能为铁、铜和氧化铝的混合物,加入足量氢氧化钠,有气体产生,铁、铜和氢氧化钠不反应,故A中还有剩余铝,故铝热反应中铝过量,X全部被还原,铝和氢氧化钠反应生成偏铝酸钠和氢气,氧化铝和氢氧化钠反应生成偏铝酸钠和水,固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,根据数据利用原子守恒计算.
解答 解:Fe2O3、CuO和铝在高温下发生铝热反应生成铁、铜和氧化铝,故固体A可能为铁、铜和氧化铝的混合物,加入足量氢氧化钠,有气体产生,铁、铜和氢氧化钠不反应,故A中还有剩余铝,故铝热反应中铝过量,X全部被还原,铝和氢氧化钠反应生成偏铝酸钠和氢气,氧化铝和氢氧化钠反应生成偏铝酸钠和水,固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,
(1)Fe3O4和铝发生反应的化学方程式为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,
故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,
(2)根据以上分析,铝热反应中铝过量,铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的方程式为:2Al+2NaOH+2H2O=2NaAlO+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO+3H2↑;
(3)固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)气体B为氢气,在标准状况下的体积为336mL,则物质的量为:$\frac{0.336L}{22.4L/mol}$=0.015mol,根据反应方程式:2Al+2NaOH+2H2O=2NaAlO+3H2↑可知,和氢氧化钠反应的铝为:0.01mol,参与铝热反应的铝为:$\frac{2.7g}{27g/mol}$-0.01mol=0.09mol,形成氧化铝结合氧为:0.09mol×$\frac{3}{2}$=0.135mol,
由于氧化铝中氧全来自X,则X中铁和铜的质量为:8.0g-0.135mol×16g/mol=5.84g,
故答案为:5.84.
点评 本题考查混合物反应的计算,题目难度较大,关键是根据和氢氧化钠反应产生气体,判断铝热反应中铝过量,计算D的质量时,运用了原子守恒,避免了列方程组的繁琐,试题培养了学生的分析能力及化学计算能力.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | H2S的燃烧热△H=-a kJ•mol-1,则表示H2S燃烧热的热化学方程式为2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
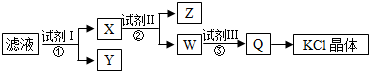
| A. | 图示的步骤中必需要经过2次过滤操作 | |
| B. | 起始滤液呈中性 | |
| C. | 试剂Ⅱ为Na2CO3溶液 | |
| D. | 试剂Ⅲ为盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与二氧化碳反应中电子转移数为0.2NA | |
| B. | 一定量的C02为0.1NA | |
| C. | 18.4g固体物质为0.lmol Na2C03和0.05molNa202的混合物 | |
| D. | 一定量的Na202为0.lmol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com