
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
| 1 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| (x+2y) |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③⑤ |
| C、②③⑥ | D、①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
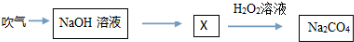
| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的液体 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com