

分析 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,根据图示信息可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸;
(1)二氧化氮可以和水发生反应但是一氧化氮不溶于水;
(2)根据元素守恒结合反应物的情况来回答;
(3)可溶性的铝盐可以和氨水反应生成氢氧化铝沉淀;
(4)A1与NO3-在碱性条件下反应的原理方程式为:8Al+3NO3-+5OH-+2H2O═8AlO2-+3NH3↑,据此来回答.
解答 解:金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,根据图示信息可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸;
(1)二氧化氮可以和水发生反应生成硝酸和一氧化氮,3NO2+H2O═2HNO3+NO,可以用水除去一氧化氮中的二氧化氮,故答案为:3NO2+H2O═2HNO3+NO;
(2)一氧化氮和二氧化氮用石灰乳吸收1:1的该混合气体,根据元素守恒则知道可以生成硝酸钙,故答案为:Ca(NO3)2;
(3)过量的氨气和可溶性的铝盐反应生成氢氧化铝,氢氧化铝不和弱碱反应,即Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故答案为:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+;
(4)A1与NO3-在碱性条件下反应的原理方程式为8Al+3NO3-+5OH-+2H2O═8AlO2-+3NH3↑,Al与被还原的NO3-的物质的量之比是8:3,故答案为:8:3.
点评 本题是一道有关元素以及化合物知识的框图推断题,考查学生分析和解决问题的能力,难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的甲基(-CH3)与羟基(-OH)所含电子数均为NA | |
| B. | 1molD216O中含中子、质子、电子各10NA | |
| C. | 32 g S8单质(分子结构如右图)中含有的S-S键个数为NA | |
| D. | 1.5g CH3+中含有的电子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇汽油是一种清洁能源,燃烧不会产生任何污染 | |
| B. | 在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 | |
| C. | 乙醇的燃烧热为683.4kJ/mol | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. |  处理尾气 | |
| D. | 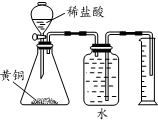 测定黄铜(Cu、Zn合金)中Zn 的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝片加入浓硫酸中,探究Al的活泼性 | |
| B. | 将NaOH溶液缓慢滴入Al2(SO4)3溶液中,观察Al (OH)3沉淀的生成及溶解 | |
| C. | 将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将Al(OH)3沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水AlCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 | B. | CH3COONa | C. | KMnO4 | D. | FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com