
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
分析 A.电负性大的元素在化合物中通常显负价,在不同的化合物中可能显正价;
B.一般非金属性强的,其第一电离能大,当价电子排布处于全满或半满状态时第一电离能较大,但金属第一电离能大,其活动性一定强;
C.第IA的H元素H比较特殊只有一个电子不容易失去,HF仍然是共价化合物;
D.元素原子外围电子排布式为3d64s2,为铁元素,当价电子排布处于全满或半满状态时稳定.
解答 解:A.电负性大的元素在化合物中通常显负价,如N电负性3.04,在化合物NH3中,H显正价、N显负价,但在二氧化氮中,氮显正价,故A错误;
B.一般非金属性强的第一电离能大,当价电子排布处于全满或半满状态时第一电离能较大,如非金属性:O>N,由于N的价电子排布为半满状态,较稳定,第一电离能:N>O,对于金属而言,第一电离能越小金属性越强,若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性一定强于Y,无特殊情况,故B错误;
C.一般认为电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,但H比较特殊只有一个电子不容易失去,故HF仍然是共价化合物,故C错误;
D.元素原子外围电子排布式为3d64s2,则此元素为铁元素,当价电子排布处于半满3d54s2时稳定,所以此元素可能易显+2和+3价,且+3价稳定,故D正确;
故选D.
点评 本题主要考查电负性、电离能等知识,明确电负性的相关应用解答本题的关键,注意第一电离能越小金属性越强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 四氯化碳 | C. | 盐酸 | D. | 硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
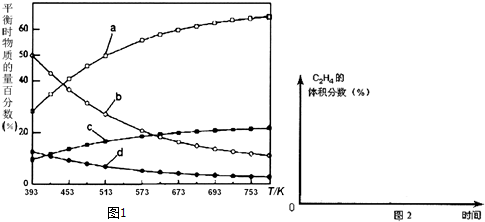
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
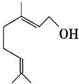 香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
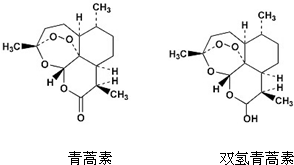 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )| A. | 两种有机物官能团的数目相同 | |
| B. | 两种有机物均可以发生取代反应 | |
| C. | 两种有机物均能和NaOH溶液反应 | |
| D. | 1mol双氢青蒿素与金属钠反应可以得到11.2L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
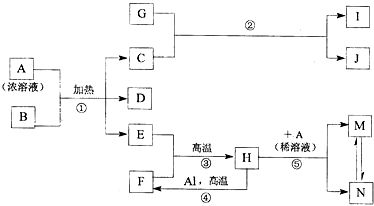
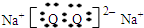 ,化合物J的俗名纯碱.
,化合物J的俗名纯碱.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
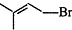
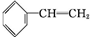 +Br2
+Br2
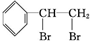 .
.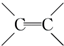 $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$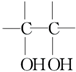 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式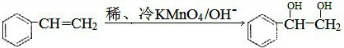 .
. .
.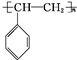 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 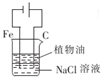 用图装置制取Fe(OH)2沉淀 | B. | 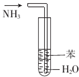 用图装置吸收NH3并防止倒吸 | ||
| C. | 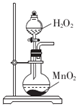 用图装置制取少量氧气 | D. | 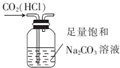 用图装置除去CO2中含有的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
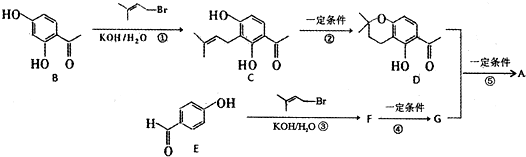
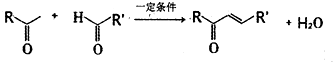
 生成高分子化合物的方程式
生成高分子化合物的方程式 .
. 、
、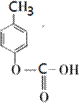 .
.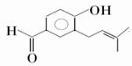 .
.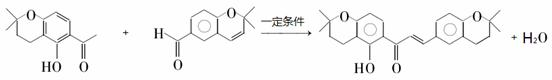 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com