
 四氯化碳
四氯化碳 CO2
CO2 HClO
HClO 氯化铵
氯化铵 Na2O2
Na2O2

分析 (1)首先判断化合物是离子化合物还是共价化合物;
若是离子化合物,其电子式 由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
(2)质子数-质量数-中子数;
(3)离子晶体:由阴阳离子按照一定的比例通过离子键集合而成的晶体,强碱、活泼金属氧化物、大多数的盐属于离子晶体;
分子晶体;分子间以范德华力相互结合形成的晶体,大多数非金属单质及其形成的化合物.
解答 解:(1)氮气分子中两个氮原子共用3对电子,电子式为: ;
;
CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为 ;
;
CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ;
;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;
;
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
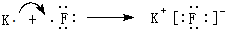
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
; ;
; ;
; ;
; ;
; ;
;
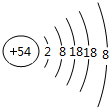
(2)质子数-质量数-中子数=23-12=11,是钠元素,钠原子结构示意图 ,故答案为:
,故答案为: ;
;
(3)根据概念判断:④是金属,属于金属晶体;
②⑦都是由分子通过分子间作用力构成的晶体,属于分子晶体;①金刚石是由碳原子通过共价键结合形成的原子晶体,⑧二氧化硅是有硅原子和氧原子通过共价键结合成的原子晶体;③氯化钠和⑤氢氧化钠都是由阴阳离子通过离子键结合成的离子晶体,
故答案为:③⑤;②⑦;①⑧.
点评 本题考查了电子式、原子结构示意图的书写以及晶体类型的判断,题目难度中等,试题题量较大,充分考查了学生对书写知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
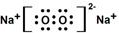 ,该物质所含有的微粒间作用力的类型为离子键、共价键.
,该物质所含有的微粒间作用力的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
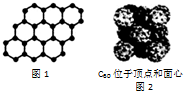
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH- )乘积不变 | B. | pH增大了 | ||
| C. | c(OH- )降低了 | D. | 水电离出的c(H+)降低了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水资源的利用包括海水水资源利用和化学资源利用 | |
| B. | 海水晒盐的过程中只发生了物理变化 | |
| C. | 从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 | |
| D. | 海水中金元素总储量很大,适合于大规模工业开采 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑩ | ||||
| 4 | ② | ④ | ⑧ |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com